Презентация на тему: К Л Е Т О Ч Ы Й Ц И К Л

Клеточный цикл и апоптоз

Введение

I Прибайкальская межрегиональная научно-практическая конференция (2006 год)

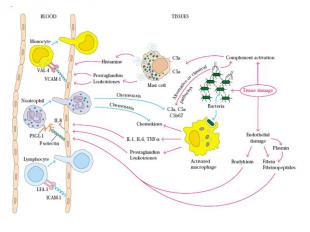
Кроветворение Кроветворение (синоним гематопоэз) — процесс, заключающийся в серии клеточных дифференцировок, в результате которых образуются зрелые клетки крови Кроветворная ткань – одна из интенсивно пролиферирующих тканей организма. Для клеточного деления клеток крови необходима сумма сигналов.
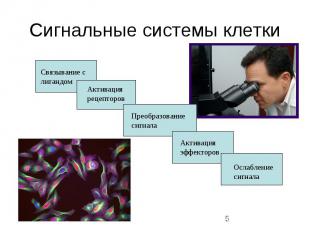
Сигнальные системы клетки

Биология сигнальных систем клетки Кроветворные клетки имеют рецепторы к экзогенным сигнальным молекулам: факторам роста, цитокинам, гормонам(стероидным и пептидным) В ответ на специфический сигнал клетка запускает каскадный механизм, реализующий интегративный путь биохимического ответа Способы передачи сигналов одинаковы для многих типов клеток клеток Специфичность клеточного ответа определяется типом экспрессируемого рецептора

Киназы и фосфатазы Фосфорилирование и дефосфорилирование - основные механизмы внутриклеточной передачи сигнала В этих профессах участвуют два типа ферментов: киназы и фосфатазы Фосфорилирование вызывает: волновую активацию белков создает в молекулах белков стыковочные участки и формирует временные внутриклеточные передатчики

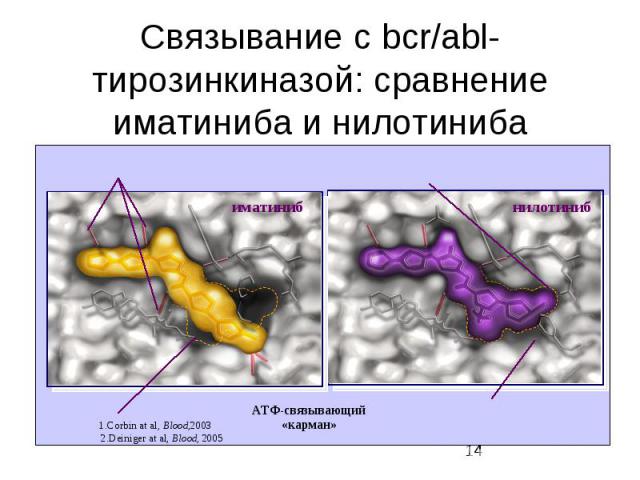
Рецепторы факторов роста Рецепторы факторов роста обычно стимулируют клеточный рост, однако при определенных условиях они могут подавлять клеточный рост или регулировать основные функции клеток. Большинство рецепторов факторов роста являются рецепторными тирозинкиназами (receptor protein-tyrosin kinases) Pецепторные тирозинкиназы являются рецепторами клеточной мембраны, активирующими тримерные G-белки, которые затем активируют эффекторные молекулы (аденилатциклазу, фосфолипазу С, протеинкиназу С и др.)
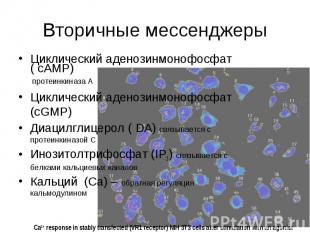
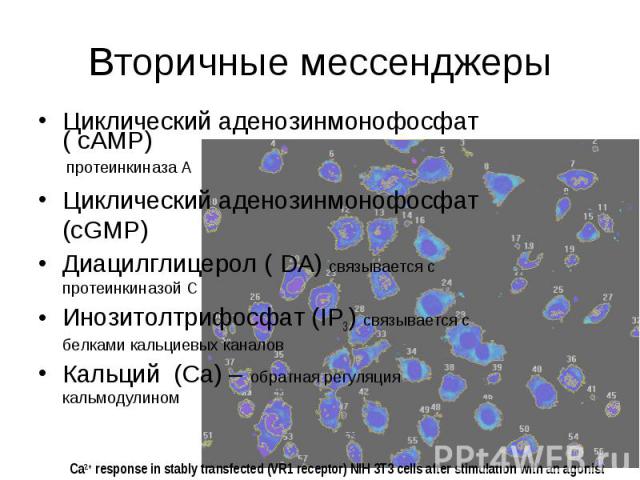
Вторичные мессенджеры Циклический аденозинмонофосфат ( cAMP) протеинкиназа А Циклический аденозинмонофосфат (cGMP) Диацилглицерол ( DA) связывается с протеинкиназой С Инозитолтрифосфат (IP3) связывается с белками кальциевых каналов Кальций (Ca) – обратная регуляция кальмодулином

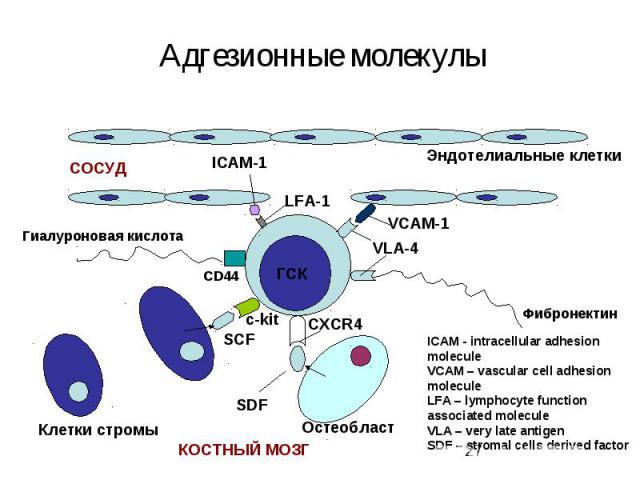
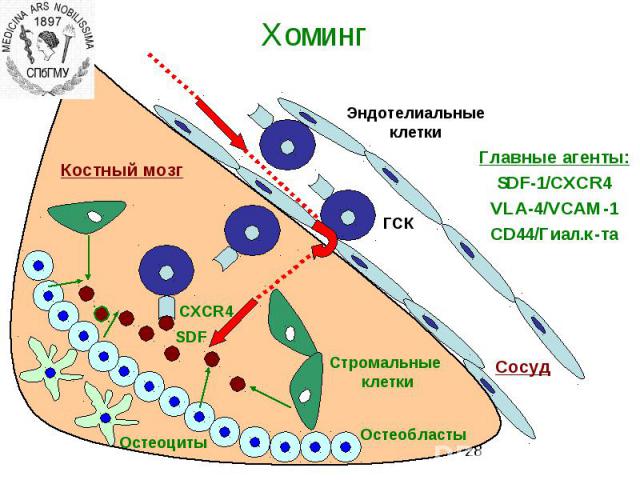
Способы доставки сигнальных молекул к клеткам Эндокринный механизм Паракринный механизм – клетка секретирует сигнальные молекулы и активирует соседние клетки. Гигнальные молекулы не поступают в кровоток. Аутокринный механизм – клетка отвечает на свой собственный сигнал Юкстакринный механизм (прикреплениек клеток крови друг к другу или к эндотелию при гемостазе или воспалении, сигнал передается через межклеточные адгезионные молекулы)

Рецепторы клеток Группа 1 Семейство липофильных рецепторов: Стероиды: ГК, МК, половые стероиды Тиреоидные гормоны, тироксин Ретиноиды, молекулы структурно сходные с витамином А и Д Группа 2 Семейство гидрофильных рецепторов Рецепторы, сопряженные с G-белками Рецепторы как ионные каналы. Pro BNP –мозговой натрийуретический пептид – выход Na Рецепторы, имеющие киназные домены Рецепторы с фосфатазной активностью Рецепторы цитокинов имеют сигналпередающие субьединицы.
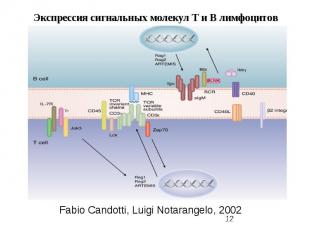
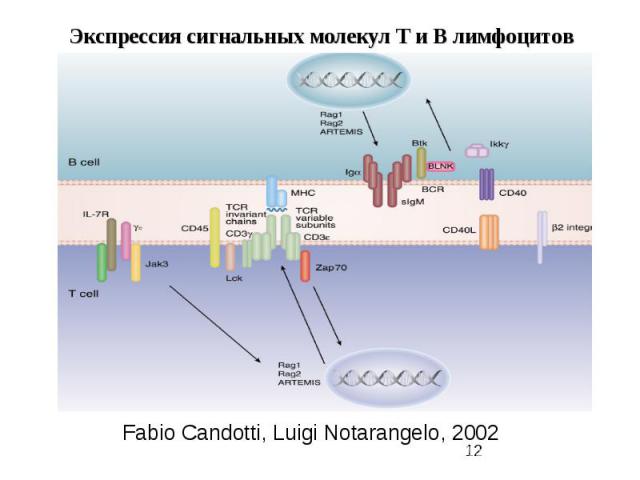
Fabio Candotti, Luigi Notarangelo, 2002
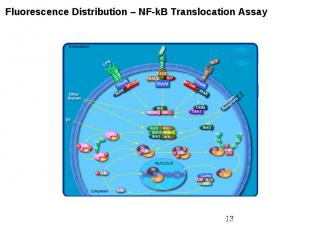
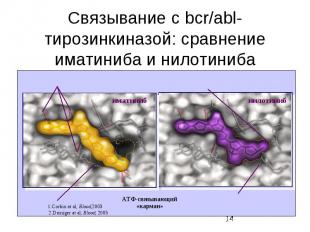

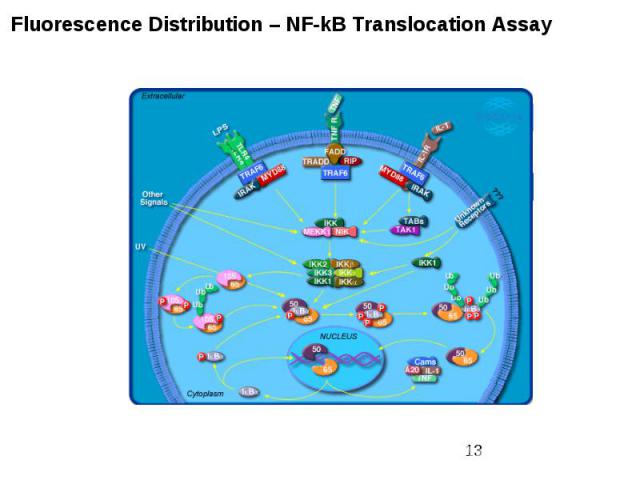
Внутриклеточные сигнальные пути Кроме активации ras-пути , в клетках существуют еще по крайней мере два пути, активируюшиеся рецепторами факторов роста . Один из них - фосфатидилинозитольный путь, приводящий к активации протеинкиназы С Другой - фосфатидилинозитол-3-киназный путь (PI3K) - использует сходные молекулы в качестве вторичных мессенджеров, однако является самостоятельным путем, клеточная функция которого еще не вполне ясна

Свойства факторов роста Факторами роста называют группу белковых молекул, индуцирующих синтез ДНК в клетке ( Goustin A.S. ea,1986 ). Позднее было обнаружено, что спектр воздействий на клетки этих компонентов гораздо шире, чем предполагалось вначале. Так, некоторые белки этой группы в зависимости от типа клеток- респондентов могут индуцировать дифференцировку и подавлять пролиферацию . Кроме того, к ним относят регуляторные полипептиды, модулирующие подвижность клеток , хемокины, но не обязательно влияющие на деление клеток ( Stoker M. and Gherardi E., 1987 ). Главное отличие факторов роста от белковых гормонов - аутокринный механизм действия или паракринный механизм действия ( холокринный механизм действия для гормонов ; Deuel T.F., 1987 ). Ростовые факторы предотвращают апоптоз клеток крови
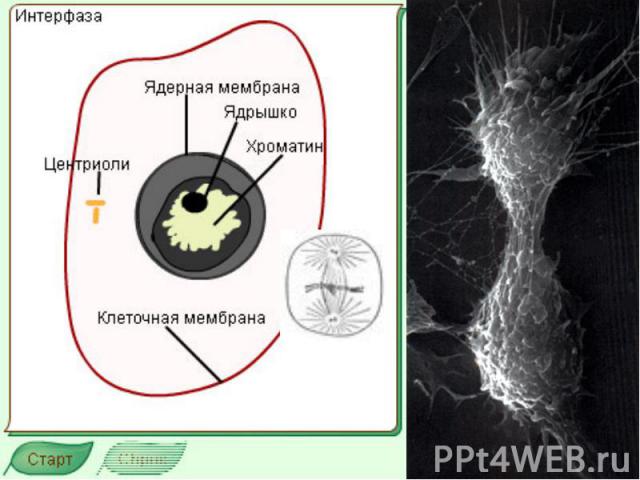
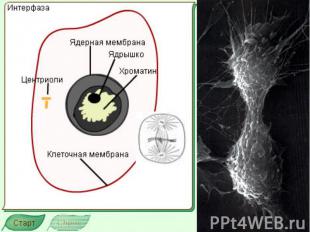
К Л Е Т О Ч Ы Й Ц И К Л Основные термины: Интерфаза Митотический цикл, Фаза G 1 Фаза G 0 Фаза S Фаза G 2 фактор, стимулирующий созревание Циклины Опухолевый супрессор Белок p 53 Ретинобластома Апоптоз Хроматин

Трубочки, колечки и висюльки Первым, как отмечают историки, клетку увидел Роберт Гук в 1663 году. Но его приспособление из пары линз давало 30−кратное увеличение, поэтому он мог видеть в изучаемых срезах пробки лишь нечто похожее на соты, которые он назвал клетками. Прибор Левенгука увеличивал уже в 300 раз — и голландец видел клетки крови, сперматозоиды и бактерии, названные им маленькими зверьками. Он вполне мог первым наблюдать и за тем, как делится клетка. В первой половине XIX века М. Шлейден и Т. Шванн, обобщив накопленные к тому времени знания, создали клеточную теорию, гласившую, что клетки — это структурная и функциональная основа всех живых организмов.

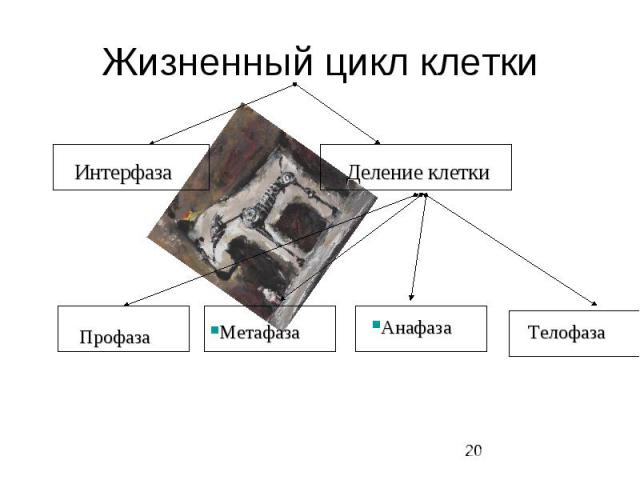
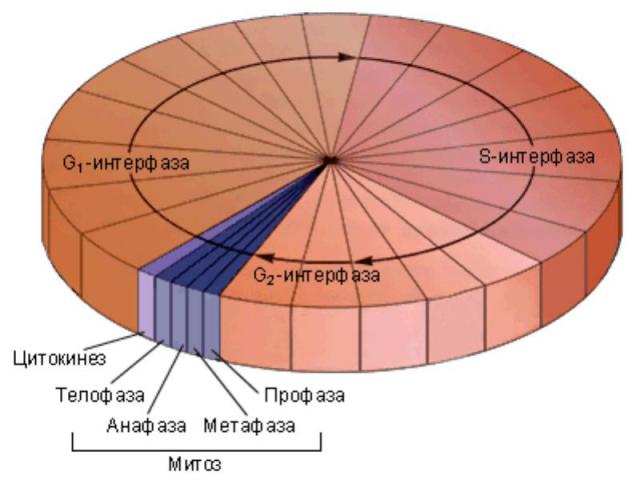
Митотический цикл Митотический цикл - совокупность последовательных и взаимосвязанных процессов в период подготовки клетки к делению, а также на протяжении самого деления. Митоз греч "митос" - нить
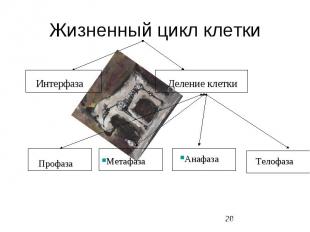
Жизненный цикл клетки
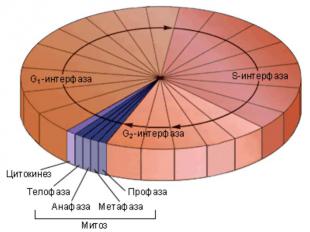

Митотический цикл Митотический цикл = фаза М – это цикл деления, который длится обычно 30-60 минут и завершается делением клетки на две дочерние.

G 0 Наступает за фазой G1 Клетка экспрессирует белки, которые используются не для клеточного деления Гены, кодирующие запуск клеточного деления «выключены» Гены, кодирующие белки, необходимые для клеточной дифференцировки «включены» Кардиомиоциты, нейроны постоянно находятся в фазе G 0 и цикл деления в них не возобновляется (все гены деления «выключены» навсегда) Исключением являются клетки крови и кишечного эпителия, где скорость клеточного деления высока Размножение при помощи митоза называют бесполым или вегетативным, а также клонированием. При митозе генетический материал родительских и дочерних клеток идентичен.

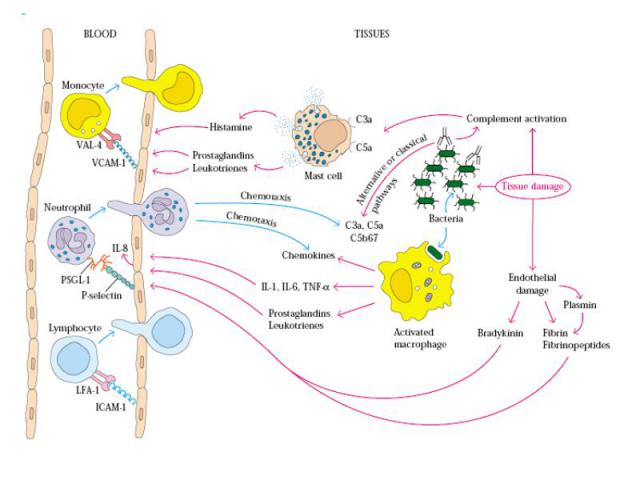
Когда нормальные клетки прекращают делиться? Гены, включающие пролиферацию выключаются, если клетка получает сигнал, что все точки «контактов» заняты. Таким образом молекулы окружающей среды-межклеточное вещество-межклеточные контакты, участвуют в управлении клеточной пролиферацией (интегрины, кадгерины, катенины)

Интегрины Интегрины-поверхностные рецепторы клетки, переносящие сигналы от внеклеточного матрикса к цитоскелету. «включают» рост, метастазирование, опухолевых клеток, апоптоз, свертывание крови и миграцию клеток в зоны воспаления Нековалентно связанные гетеродимеры из α (16 разновидностей) и β (8 разновидностей ) субьединиц Интегрины, формирующие межклеточные контакты, называются ICAM – межклеточными молекулами адгезии Интегрины способсвуют связыванию клеток с внеклеточным матриксом: фибронектином, коллагеном, ламинином.
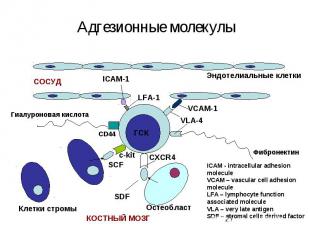
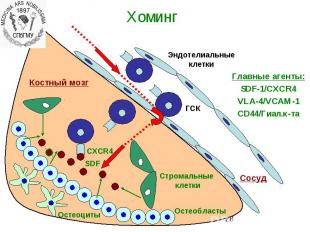
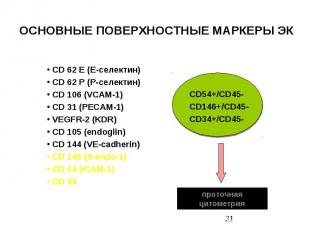
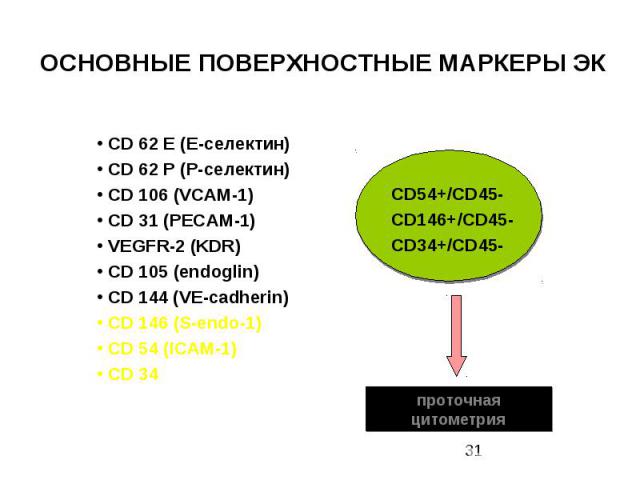
ОСНОВНЫЕ ПОВЕРХНОСТНЫЕ МАРКЕРЫ ЭК

Роль циклинов Деление клетки запускается MPF В клетках млекопитающих существует семейство циклинзависимых киназ (cyclin-dependent kinases –Cdk). Cdk пронумерованы с 1 по 5. В период выхода клетки из фазы G0 под действием факторов роста первым образуется комплекс циклин Д- Cdk. Этот комплекс запускает синтез белков, необходимых для репликации ДНК. Циклинов четыре: А, В, Е, Д.

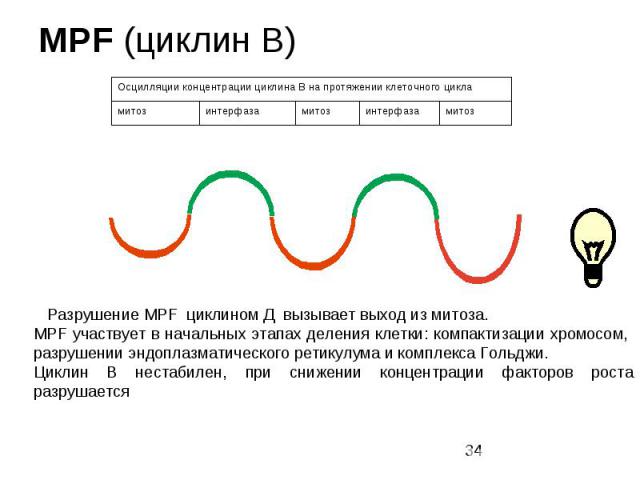
Циклин В Циклин В – контролирует вхождение клеток в митоз. Состоит из 2 субьединиц: - киназного домена ( способен к фосфорилированию специфических веществ в клетке) и - регуляторной субьединицы (циклиновой), синтез которой усиливается и ослабевает в течение клеточного цикла. Разрушение циклина Д происходит не за счет протеолиза, как у большинства белков, а за счет присоединения к N-концевому пептиду, который называется «блок разрушения» как минимум двух белков (распознающий и убиквитинлигазы) после чего его разрушение происходит в протеасоме. Для вступления клетки в митоз необходим еще один сигнал – это MPF – регулятор митотических процессов. Разрушение MPF циклином Д вызывает выход из митоза. MPF участвует в начальных этапах деления клетки: компактизации хромосом, разрушении эндоплазматического ретикулума и комплекса Гольджи.
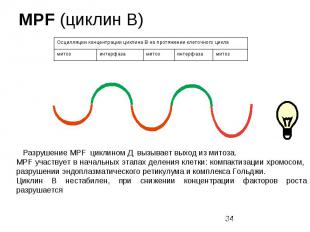
MPF (циклин В)

Митоз Сопровождается: Компактизацией, конденсацией хромосом, в 10 000 раз в нуклеосомы в середине G2 фазы Растворением ядерной оболочки (ламин А и В) Формированием веретена деления и выравниванием хромосом в плоскости экватора клетки (с помощью центриолей, астральных и полярных микротрубочки, кинетохора) Расхождением сестринских хроматид к полюсам клетки (динеин, кинезин), образуются борозды деления, клетка окончательно делится на две дочерние (актин, миозин).
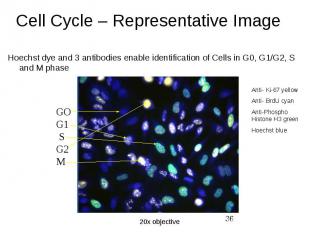
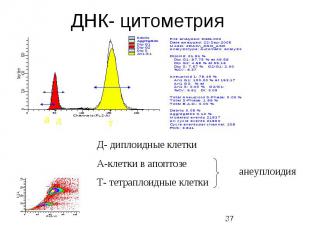
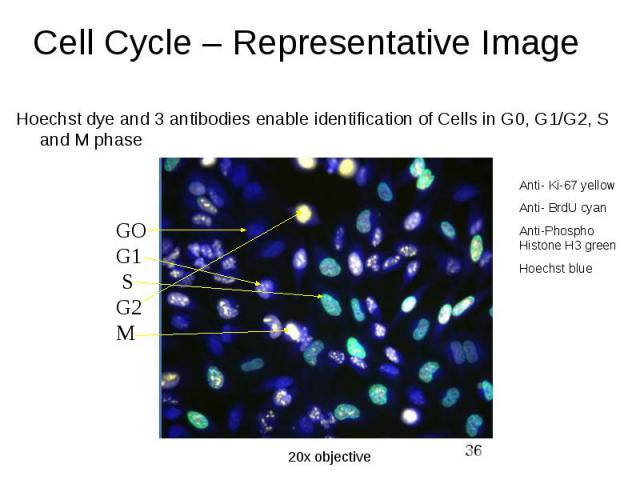
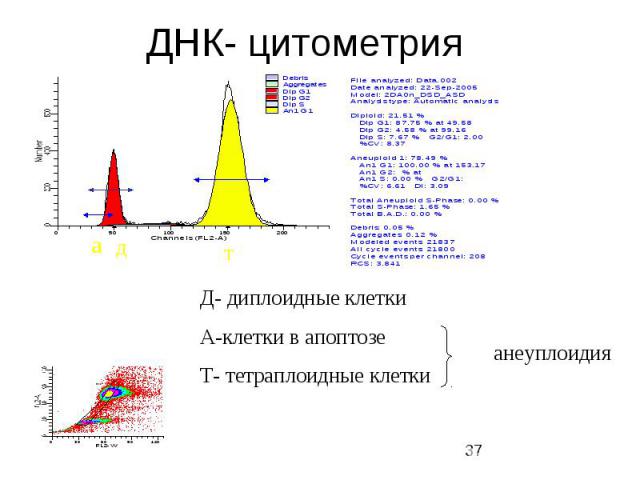
ДНК- цитометрия
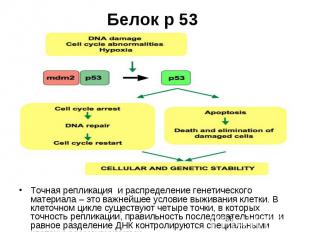
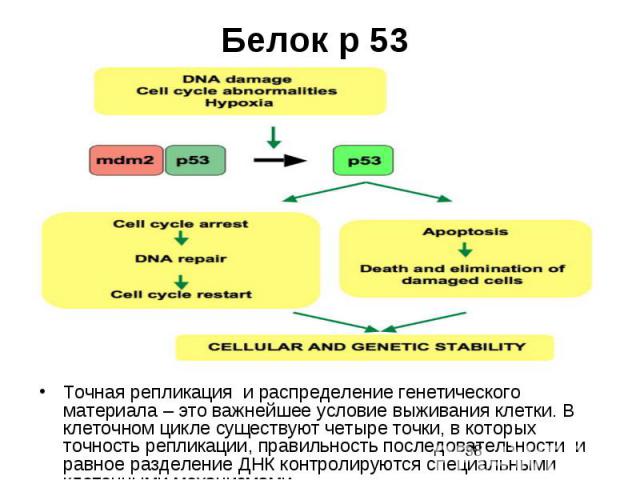
Белок р 53 Точная репликация и распределение генетического материала – это важнейшее условие выживания клетки. В клеточном цикле существуют четыре точки, в которых точность репликации, правильность последовательности и равное разделение ДНК контролируются специальными клеточными механизмами.

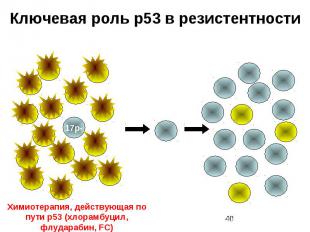
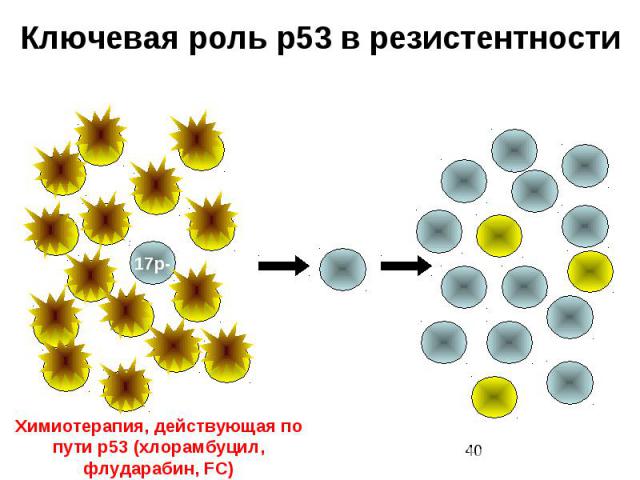
Ключевая роль p53 в резистентности


Протоонкогены – гены, чьи продукты участвуют в регуляции клеточной пролиферации. Протоонкогены – гены, чьи продукты участвуют в регуляции клеточной пролиферации. Мутации этих генов приводят к неконтролируемой пролиферации и протоонкоген может стать онкогеном (хромосомные транслокации, точечные мутации, амплификация)

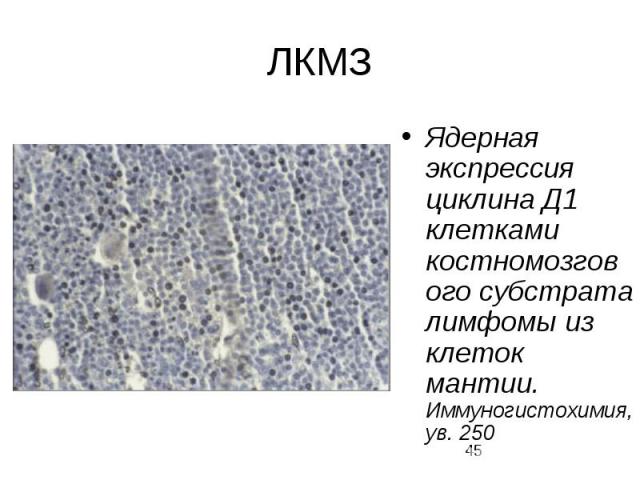
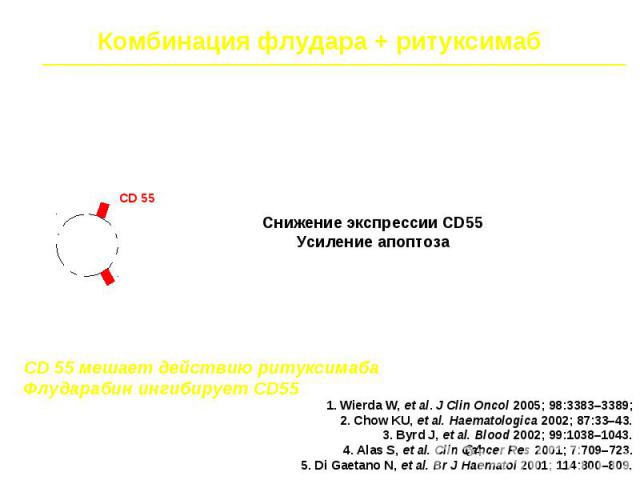
ЛКМЗ В-клеточная опухоль, характеризующаяся транслокацией или амплификацией локуса 11q13, приводящими к гиперэкспрессии ядерного белка циклина D1 Циклин D1, в комплексе с циклинзависимыми киназами 4 и 6 (ЦЗК4/6) является регулятором перехода клеток из G1 в S-фазу клеточного цикла. В группу циклинов D1 входят 3 белка: D1 D2 D3, в лимфоцитах в норме эксперессируется D3. (D1 эксапрессируется только в эпителиальных и мезенхимальных клетках. ) В кариотипе опухолевых клеток выявляется патогенетическая транслокация t(11;14)(q13;q32), приводящая к гиперэкспресии ядерного белка циклина D1 и нарушению обратной регуляции клеточного цикла. В клетке существует два класса ингибиторов комплекса циклин D1: - семейство Cip/Kip представлено белками р21, р27 и р57 - семейство INK4 представлено белками р15 и р16, р18 и р19. Эти гены избирательно блокируют циклин D-зависимые киназы. Вторичные цитогенетические нарушения при прогрессии лимфомы из клеток мантийной зоны связаны с делециями именно этих генов.
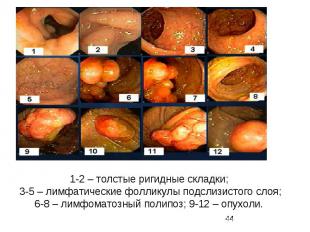
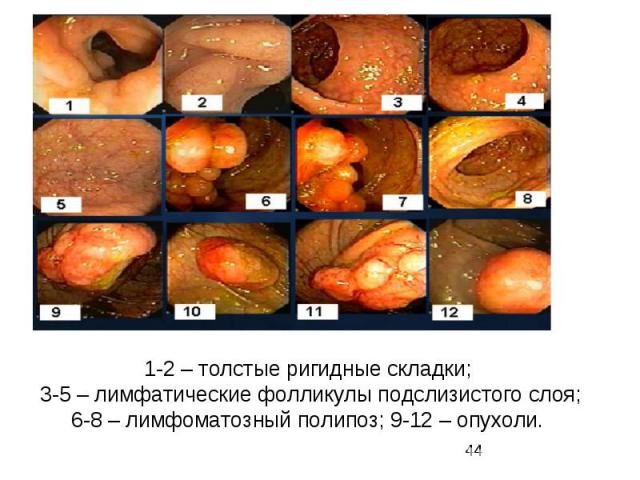
1-2 – толстые ригидные складки; 3-5 – лимфатические фолликулы подслизистого слоя; 6-8 – лимфоматозный полипоз; 9-12 – опухоли.
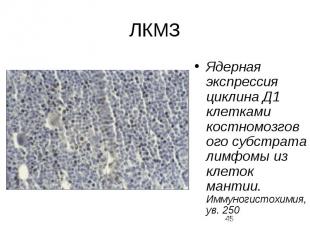
ЛКМЗ Ядерная экспрессия циклина Д1 клетками костномозгового субстрата лимфомы из клеток мантии. Иммуногистохимия, ув. 250
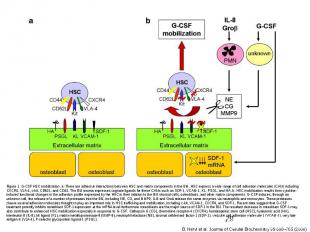
Регуляция клеточного цикла в тканях При разработке метода выращивания клеток в культуре, было отмечено, что клетки растут лучше, если находятся внутри кровяных сгустков. Это вещество – тромбоцитарный фактор роста – PDGF Факторы роста с широким диапазоном клеточной и тканевой специфичности: PDGF, EGF, FGF, NGF, EPO, IL-2,IL-3

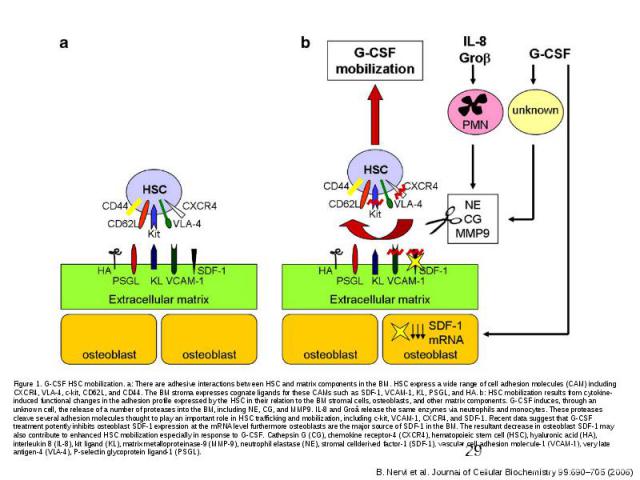
Факторы роста Факторы роста Семейство тромбоцитарных факторов роста (PDGF) : PDGF A, PDGF B, VEGF, PLGF,CSF-1 SCF-стабильный фактор; Семейство факторов роста фибробластов (FGF) : α FGF, βFGF, int-2, K-FGF, FGF-5, GFG-6, KGF,FGF-8, FGF-9; Cемейство инсулинов: инсулин, инсулиноподобный фактор роста IGF-1, инсулиноподобный фактор роста IGF-2; Семейство эпидермальных факторов роста (EGF) Фактор роста опухолей α Семейство факторов роста нервов NGF NGF, BDNF, NT-3,4,5, Семейство факторов роста гепатоцитов HGF Колониестимулирующие факторы CSF Гранулоцит-колониестимулирующий фактор G-CSF, Моноцит-колониестимулирующий фактор M-CSF, Гранулоцит-моноцит-колониестимулирующий фактор GM-CSF Трансформирующие фактор роста TGFβ BMP

Старение - феномен Хейфлика. Клетки запрограммированы на определенное число делений, а затем прекращают делиться Репликативное старение – сокращение длины теломер – повышение экспрессии р21, ингибитора циклинзависимых киназ Существуют серьезные доказательства, что окислительное воздействие и ограничение калорий являются ключевыми факторами в процессе старения

Теломеры Теломеры-это концевые участки хромосом, которые содержат повторяющиеся последовательности ДНК и укорачиваются с каждой репликацией. В самообновляющихся и активно делящихся популяциях клеток (например, стволовых) действует фермент теломераза, способный наращивать теломерные последовательности. От степени сохранности теломер зависит пролиферативный потенциал клетки; в опухолевых клетках длины теломер обычно поддерживается на постоянном уровне

Апоптоз – программируемая клеточная гибель. Регуляция процессов клеточного деления необходима для выживания организма. Размножение клеток зависит от скорости пролиферации и смерти клеток. Скорость клеточной смерти зависит от скорости стимулирования и ингибирования клеточной смерти. Систематическое удаление клеток путем апоптоза ( apo-полное ptosis –падение,утрата) в переводе с греческого опадание цветочных лепестков, «осенний листопад»). Этот термин впервые применен в 1972 году J.F.Kerr для описания конкретной морфологической картины одного из видов клеточной смерти. Удаление умирающих клеток при апоптозе происходит без воспаления Некроз-патологическая форма смерти клеток в результате их острого повреждения, разрыва оболочки, высвобождения содержимого цитоплазмы и индукции воспалительного процесса

Апоптоз – программируемая клеточная гибель. француз Бонне различал следующие четыре типа ядерной дегенерации: Кариорексис - хроматин распадается на бесформенные скопления обломков и гранул, которые после разрыва ядерной оболочки попадают в цитоплазму и там дегенерируют Кариопикноз - "хроматиновая сеть" отстает полностью или почти полностью от ядерной оболочки и слипается в гомогенную массу. Ядерная оболочка сморщивается, ядро теряет тургор, хроматин распыляется и отдельные его гранулы растворяются в цитоплазме. Кариолизис или хроматолиз - хроматин постепенно растворяется. Ядро и цитоплазма в начале окрашиваются основными красителями весьма интенсивно, но затем хроматин теряет свои морфологические и химические особенности и ядерное вещество переходит в цитоплазму и там растворяется. Вакуолизированная ядерная дегенерация - в ядре появляется одна или несколько вакуолей, которые постепенно увеличиваются, оттесняя хроматин к периферии ядра и здесь он образует отдельные скопления
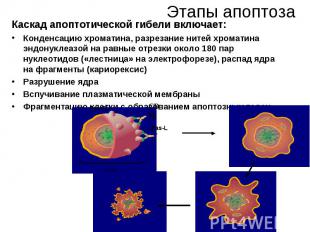
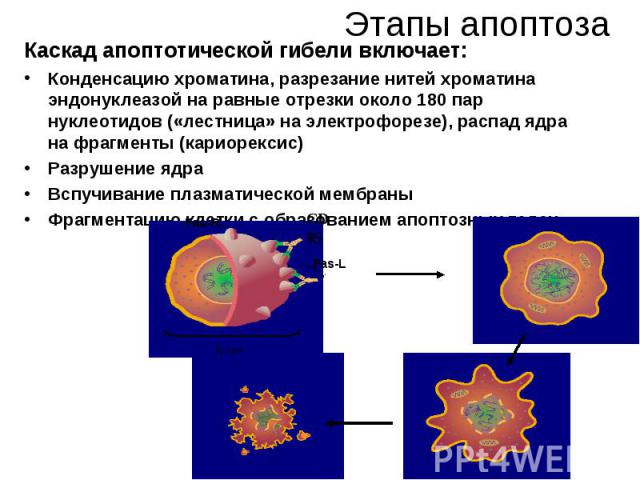
Этапы апоптоза Каскад апоптотической гибели включает: Конденсацию хроматина, разрезание нитей хроматина эндонуклеазой на равные отрезки около 180 пар нуклеотидов («лестница» на электрофорезе), распад ядра на фрагменты (кариорексис) Разрушение ядра Вспучивание плазматической мембраны Фрагментацию клетки с образованием апоптозных телец.

Механизмы апоптоза 2 фазы: Формирование и проведение апоптотического сигнала –фаза принятия решения Демонтаж клеточных структур –эффекторная фаза. Каспазы (цистеиновые протеазы) расщепляют белки в местах расположения аспарагиновых оснований

Каспазы Семейство протеаз, участвующих в апоптозе Существует 14 видов каспаз Активаторы цитокинов (каспазы 1,4, 5, 13) Индукторы активации эффекторных каспаз (каспазы 2,8,9,10) ICAD Эффекторные каспазы-исполнители апоптоза (каспазы 3,6,7) После активации казпазы 9, затем каспазы 3, белок Bax накапливается, образует гомодимеры и инициирует высвобождение цитохрома С. Ингибирует апоптоз каспаза Bcl-2 Ускоряет апоптоз белок Bad, образующий гетеродимеры с Bcl-2

Сигнальные пути апоптоза Повреждение ДНК, радиация, токсические воздействия, глюкокортикоиды, укорочение теломер приводит к активации каспазы 9 Проапоптотические сигналы Fas-R, TNF-R, активация каспазы 8, Ca 2+ (зависимый от протеинкиназы C) Инициация апоптоза происходит под действием : двухвалентных ионов Ca 2+ (проапоптоз-мобилизация внутриклеточного депо Са) , недостатка Zn2+ (антиапоптоз, за счет подавления эндонуклеазы) изменения мембран апоптотических клеток

Изменения мембран апоптотических клеток Клеточная мембрана апоптозной клетки теряет сиаловую кислоту на гликопротеинах и гликолипидах, входящих в ее состав Клетка становится доступной для фагоцитоза Макрофаги притягивают экспрессирующиеся рецепторы для витронектина Поверхностное расположение фосфатидилсерина
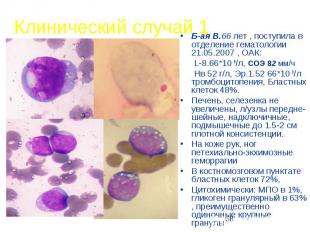
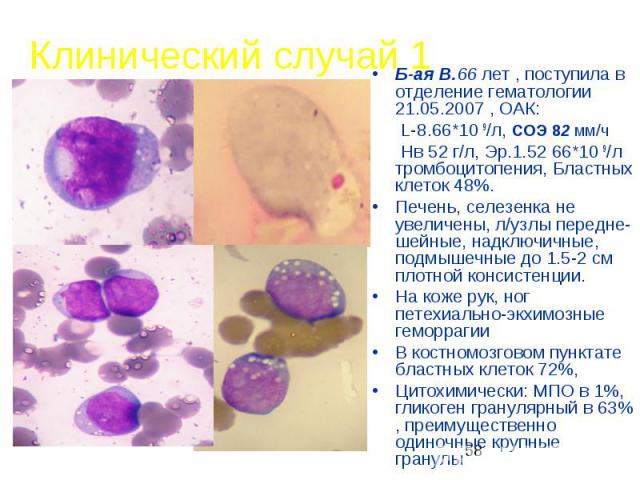
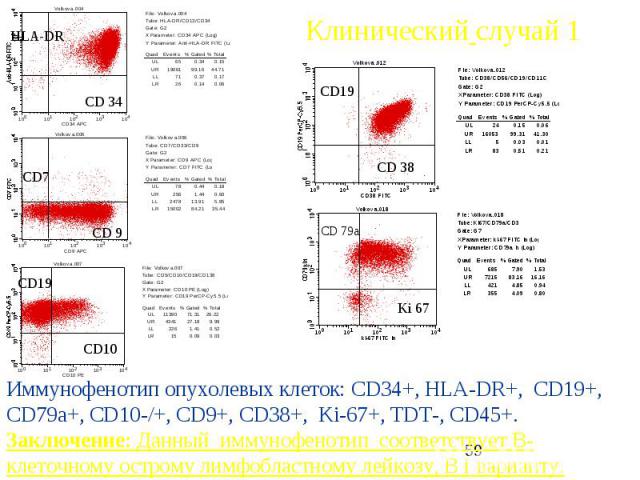
Клинический случай 1 Б-ая В.66 лет , поступила в отделение гематологии 21.05.2007 , ОАК: L-8.66*10 9/л, СОЭ 82 мм/ч Нв 52 г/л, Эр.1.52 66*10 9/л тромбоцитопения, Бластных клеток 48%. Печень, селезенка не увеличены, л/узлы передне-шейные, надключичные, подмышечные до 1.5-2 см плотной консистенции. На коже рук, ног петехиально-экхимозные геморрагии В костномозговом пунктате бластных клеток 72%, Цитохимически: МПО в 1%, гликоген гранулярный в 63% , преимущественно одиночные крупные гранулы
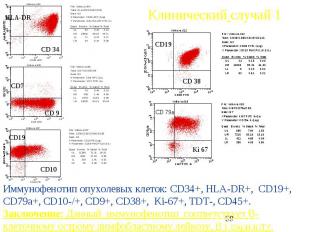
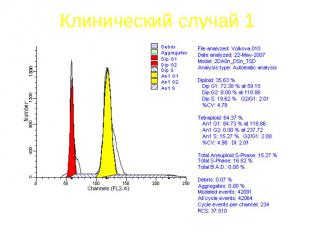
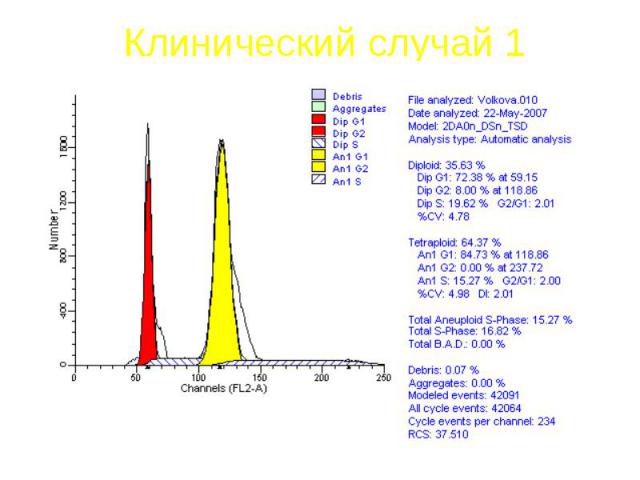
Клинический случай 1
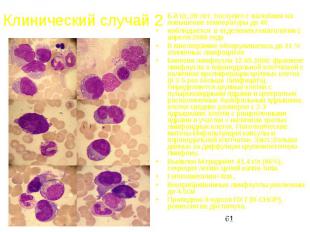
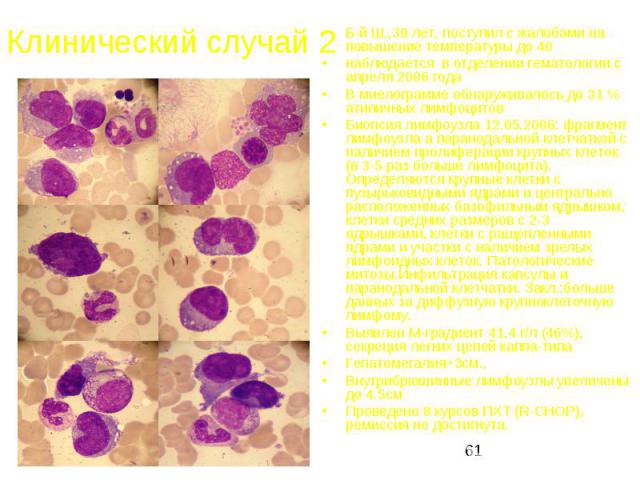
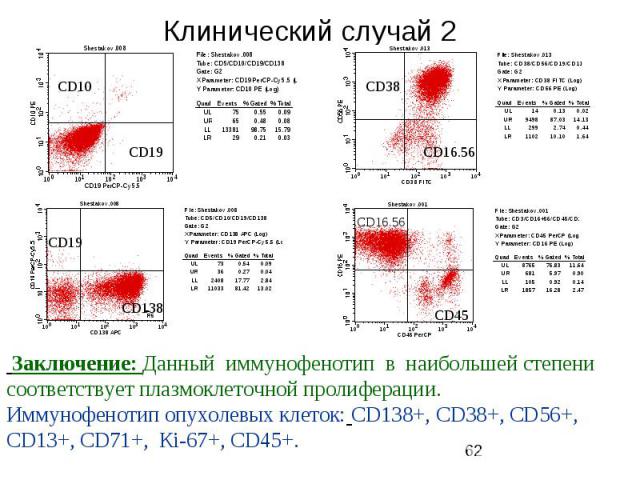
Клинический случай 2 Б-й Ш.,39 лет, поступил с жалобами на повышение температуры до 40 наблюдается в отделении гематологии с апреля 2006 года В миелограмме обнаруживалось до 31 % атипичных лимфоцитов Биопсия лимфоузла 12.05.2006: фрагмент лимфоузла а паранодальной клетчаткой с наличием пролиферации крупных клеток (в 3-5 раз больше лимфоцита). Определяются крупные клетки с пузырьковидными ядрами и центрально расположенных базофильным ядрышком, клетки средних размеров с 2-3 ядрышками, клетки с ращепленными ядрами и участки с наличием зрелых лимфоидных клеток. Патологические митозы.Инфильтрация капсулы и паранодальной клетчатки. Закл.:больше данных за диффузную крупноклеточную лимфому. Выявлен М-градиент 41,4 г/л (46%), секреция легких цепей каппа-типа Гепатомегалия+3см., Внутрибрюшинные лимфоузлы увеличены до 4.5см Проведено 8 курсов ПХТ (R-CHOP), ремиссия не достигнута.
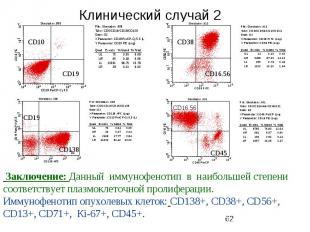
Клинический случай 2
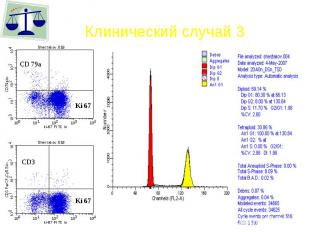
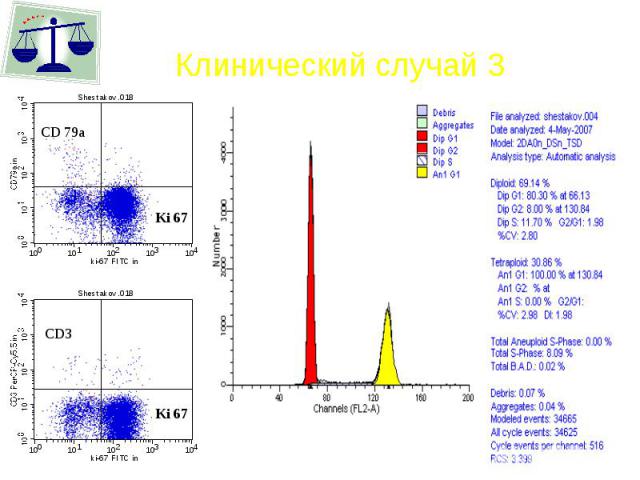
Клинический случай 3



ЛИТЕРАТУРА Кассирский И.А. и Алексеев Г.А. Клиническая гематология. М., 1970; Максимов А.А. Основы гистологии, ч. 1—2, Л., 1925; Руководство по гематологии, под ред. А.И. Воробьева, М., 2002; Чертков И.Л. и Воробьев А.И. Современная схема кроветворения, Пробл. гематол и перелив. крови, 1973, т. 18, №10, с, 3, библиогр.; Чертков И.Л. и Фриденштейн А.Я. Клеточные основы кроветворения, М., 1977, библиогр. Д.М. Фаллер, Д. Шилдс Молекулярная биология клетки. М., Бином-пресс, 2006, 260 с. Е.Б.Владимирская Биологические основы противоопухолевой терапии.-М.,2001.-110 с.