Презентация на тему: Водород

ВОДОРОД

Генри Кавендиш Первым убедился,что при действии кислот на некоторые металлы образуется«ГОРЮЧИЙ ГАЗ», который в смеси с воздухом при поджигании взрывается

Антуан Лавуазье Первым установил, что водород при сгорании образует воду, и назвал его Hydrogenium – «рождающий воду» 2H2 + О2 –> 2Н2О

Распространение в природе В земной коре – массовая доля всего – 1% (из-за малой массы атомов водорода); Входит в состав воды, кислот, нефти, природного газа, большинства органических и многих неорганических веществ; Во Вселенной – водород самый распространенный элемент: в виде плазмы он составляет 50-80% массы Солнца.
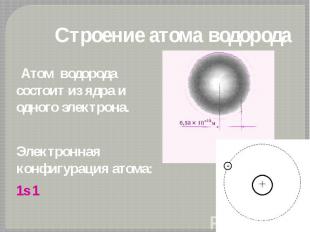
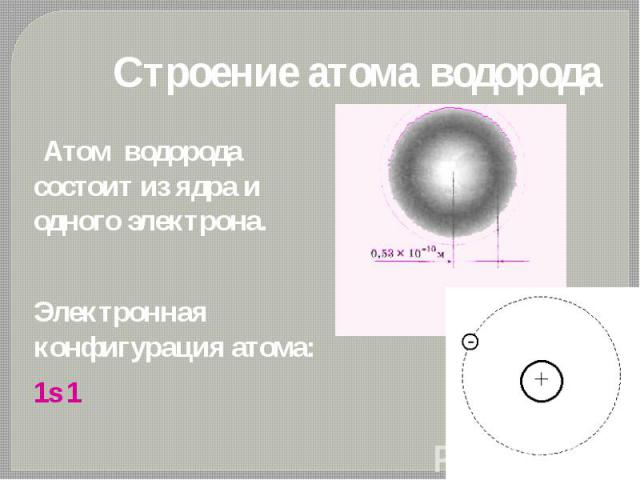
Строение атома водорода Атом водорода состоит из ядра и одного электрона. Электронная конфигурация атома: 1s 1
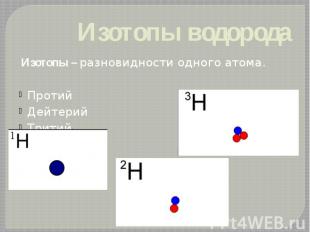
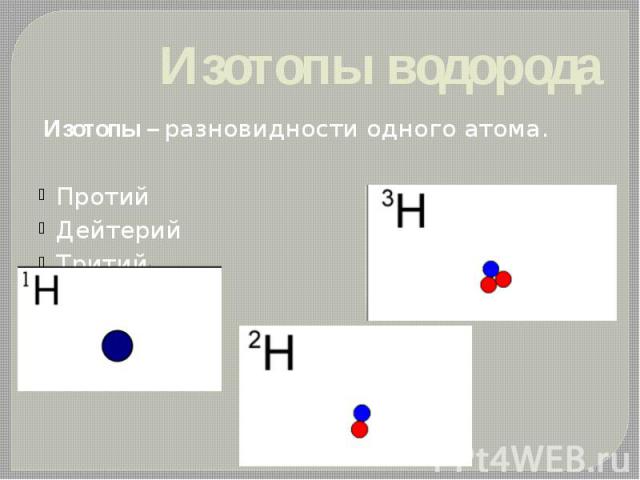
Изотопы водорода Изотопы – разновидности одного атома. Протий Дейтерий Тритий
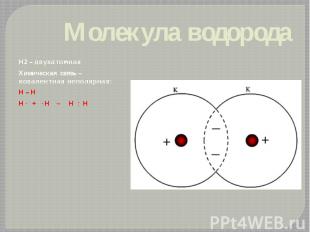
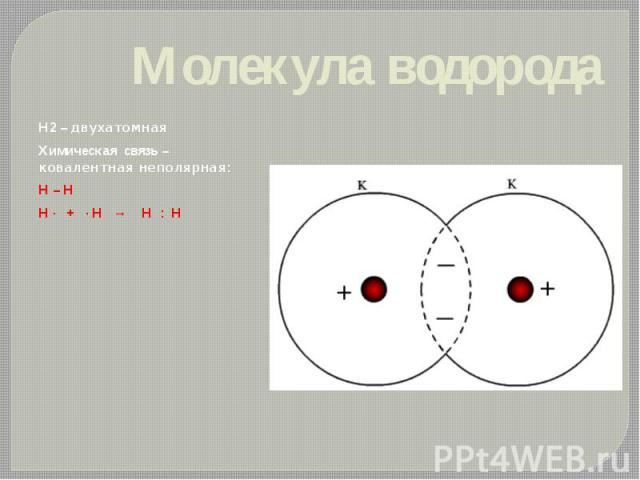
Молекула водорода Н2 – двухатомная Химическая связь – ковалентная неполярная: H – H H · + · H → H : H

Физические свойства Бесцветный газ Без запаха Почти нерастворим в воде ( 1: 50 ) Плотность – 0,0899 кг/м3 В 14,5 раз легче воздуха При -252,8 0С водород сжижается
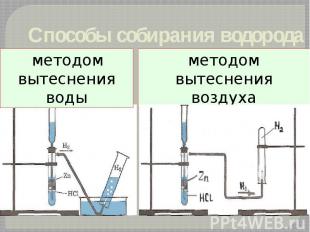
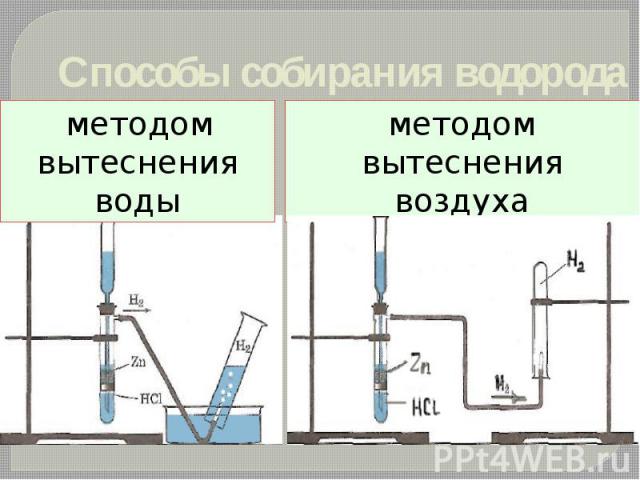
Способы собирания водорода

Химические свойства обладает окислительно-восстановительной амфотерностью восстановительные св-ва: А . С НЕМЕТАЛЛАМИ 2Н2 + Сl2 = 2НCl 2Н2 + О2 = 2Н2О Н2 + S = Н2S Б. C ОКСИДАМИ МЕТАЛЛОВ Н2 + СИО = СИ + Н2О

Применение