Презентация на тему: Водород

Водород

Водород в ПСХЭ ВОДОРОД - H, химический элемент с атомным номером 1, атомная масса 1,00794. Характеризуя водород по положению в периодической системе Менделеева, Следует обратить внимание на особенности строения Атома водорода — самого простейшего из химических элементов (состоит из ядра, представляющего собой один протон, и одного электрона). Элемент водород расположен в первом периоде таблицы Менделеева. Его относят и к 1-й группе, и к 7-й группе.

Строение атома Z=+1 +1p=1 0n=1-1=0 e=1 +1)1 В соединениях проявляет степень окисления +1 и, реже, –1 (валентность I).

Физические свойства Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха. Так же водород горит, посмотрим это на опыте:

Нахождение в природе Водород является одним из наиболее распространённых элементов - его доля составляет 0,88% от массы всех трёх оболочек земной коры (атмосферы, гидросферы и литосферы), что при пересчёте на атомные проценты даёт цифру 15,5. Основное количество этого элемента находится в связанном состоянии. В виде соединений с углеродом водород входит в состав нефти, горючих природных газов и всех организмов. Свободный водород состоит из молекул Н2. Он часто содержится в вулканических газах. Частично он образуется также при разложении некоторых органических остатков. Небольшие его количества выделяются зелёными растениями. Атмосфера содержит около 10-5% объёма водорода.

Химические свойства 1) N2 + 3H2 → 2NH3 (аммиак) 2) F2 + H2 → 2HF (фтороводород) 3) C + 2H2 → CH4 (метан) 4) Na + H2 → 2NaH (гидрид натрия) 5) CuO + H2 → Cu + H2O 6) CH2=CH2 + H2 → CH3-CH3 (этан) Смесь с воздухом – ГРЕМУЧИЙ ГАЗ

Получение В промышленности: 2NaCl + 2H2O → H2↑ + 2NaOH + Cl2 СН4 + 2Н20 = CO2 + 4Н2 — 165 кДж H2O + C ⇄ H2 + CO CH4 + H2O ⇄ CO + 3H2 (1000 °C) Крекинг и реформинг углеводородов в процессе переработки нефти В лаборатории: Zn + 2HCl → ZnCl2 + H2↑ Ca + 2H2O → Ca(OH)2 + H2↑ NaH + H2O → NaOH + H2↑ 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑ Тетрагидротсоцинкат дикалия

Водород не растворяется в воде. Докажем это опытом:

Историческая справка 16 в.- Парацельс и Р.Бойль описывали Н2. 1700 г.- Н. Лемери –газ, образующийся при действии Н2SO4 на Fе- взрывается. 1766 г. Г. Кавендиш открыл Н2 и назвал «горючим воздухом». 1781 г. А. Лавуазье доказал, что Н2О это продукт взаимодействия Н2 и О2 (Н2 - от греч. «рождающий Н2О). 1824 г. М.Ф.Соловьев предложил русское название «водород» Г. Кавендиш Парацельс А. Лавуазье Н. Лемери Р. Бойль

История открытия Выделение горючего газа при взаимодействии кислот и металлов наблюдали в 16 и 17 веках на заре становления химии как науки. Знаменитый английский физик и химик Г. Кавендиш в 1766 исследовал этот газ и назвал его «горючим воздухом». В 1787 Лавуазье пришел к выводу, что «горючий воздух» представляет собой простое вещество, и, следовательно, относится к числу химических элементов. Он дал ему название hydrogene (от греческого hydor — вода и gennao — рождаю) — «рождающий воду». Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году. М.Ф.Соловьев.

Применение В настоящее время водород получают в огромных количествах. Очень большую часть его используют при синтезе аммиака, гидрогенизации жиров и при гидрировании угля, масел и углеводородов. Кроме того, водород применяют для синтеза соляной кислоты, метилового спирта, синильной кислоты, при сварке и ковке металлов, а также при изготовлении ламп накаливания и драгоценных камней. В продажу водород поступает в баллонах под давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной надписью "Водород".Водород используется для превращения жидких жиров в твердые, производства жидкого топлива гидрогенизацией углей и мазута. В металлургии водород используют как восстановитель оксидов или хлоридов для получения металлов и неметаллов. Практическое применение водорода многообразно: им обычно заполняют шары-зонды, в химической промышленности он служит сырьём для получения многих весьма важных продуктов (аммиака и др.), в пищевой - для выработки из растительных масел твёрдых жиров и т. д. Высокая температура (до 2600 °С), получающаяся при горении водорода в кислороде, используется для плавления тугоплавких металлов. Водород применяют как для полезных дел, так и для вредного применения.
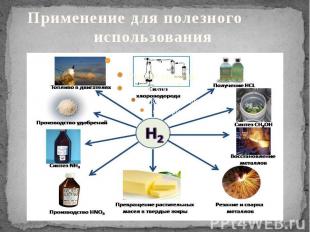
Применение для полезного использования

Применение для вредного использования ВОДОРОДНАЯ БОМБА, оружие большой разрушительной силы (порядка мегатонн в тротиловом эквиваленте), принцип действия которого основан на реакции термоядерного синтеза легких ядер. Источником энергии взрыва являются процессы, аналогичные процессам, протекающим на Солнце и других звездах.

Дирижабль Дирижабли – это управляемые аэростаты с сигарообразной оболочкой, наполненной водородом. Большой объем водорода в оболочке обеспечивал высокую грузоподъемность этих воздушных кораблей. На снимке вы видите один из первых дирижаблей небольшого размера, но крупнейшие пассажирские дирижабли 30-х годов XX века могли перевозить до 100 человек на очень большие расстояния. Такие дирижабли совершали регулярные рейсы из Европы в Америку.