Презентация на тему: Валентные состояния атома углерода

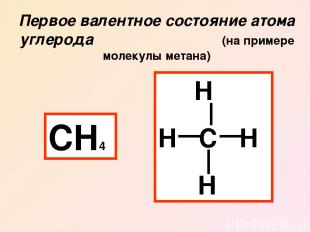
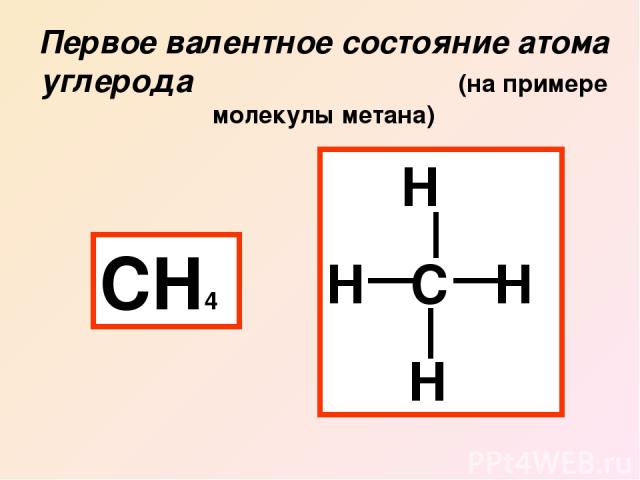
Первое валентное состояние атома углерода (на примере молекулы метана) СН4 Н Н С Н Н

Два «противоречия» в строении метана: Валентность углерода равна четырем в наличии только 2 валентных электрона Решение: 1 противоречие: Выход в возбужденное состояние атома углерода

2 противоречие: В молекуле все четыре связи одинаковые по теории – одна SS связь и три SP связи Решение: SP гибридизация 3
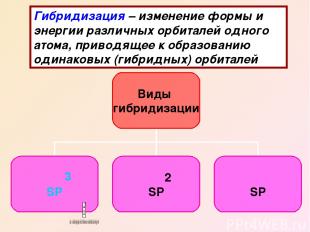
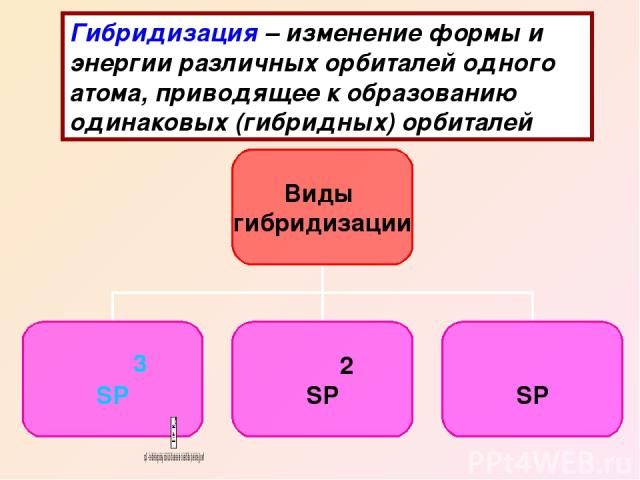
Гибридизация – изменение формы и энергии различных орбиталей одного атома, приводящее к образованию одинаковых (гибридных) орбиталей

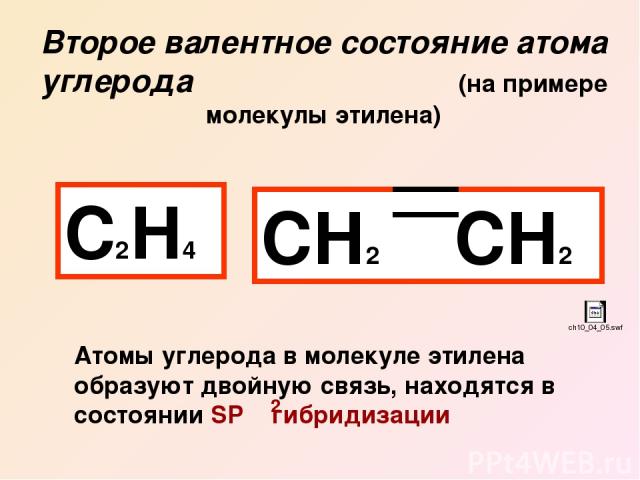
Второе валентное состояние атома углерода (на примере молекулы этилена) С2Н4 СН2 СН2 Атомы углерода в молекуле этилена образуют двойную связь, находятся в состоянии SP гибридизации 2

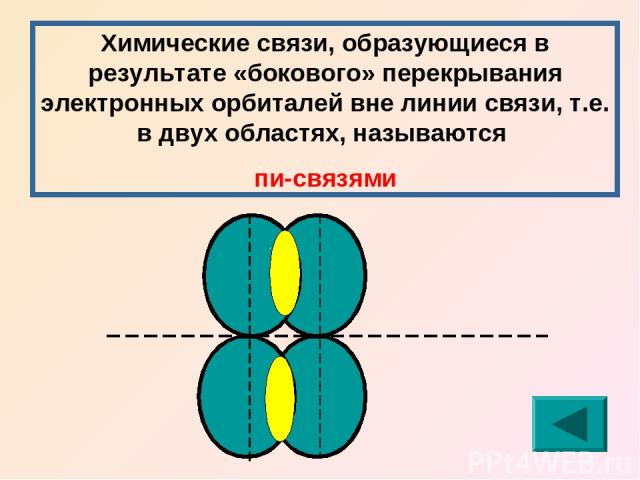
Связи в этилене неравноценны: (сигма) – более прочная (пи) – легче рвется, более реакционноспособна, плотность электронного облака максимально сконцентрирована «над» и «под» плоскостью сигма связи (боковое перекрывание)

Признаки сравнения Сигма-связь Пи-связь Образование связи Вид перекрывания эл.облаков Осевое (связи находятся на прямой, соединяющей центры атомов) Боковое (связи вне плоскости сигма-связи, взаимно перпендикулярны) Степень перекрывания значительная небольшая Участвуют Гибридные эл.облака Негибридные эл.облака Положение связи В плоскости молекулы Перпендикулярна плоскости сигма- связи
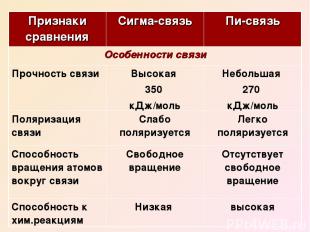
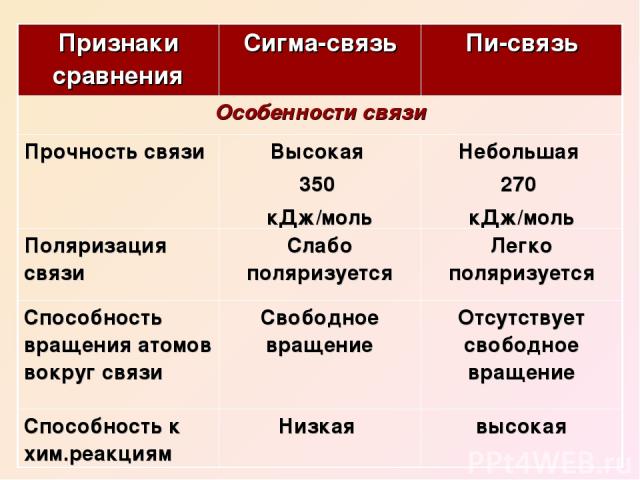
Признаки сравнения Сигма-связь Пи-связь Особенности связи Прочность связи Высокая 350 кДж/моль Небольшая 270 кДж/моль Поляризация связи Слабо поляризуется Легко поляризуется Способность вращения атомов вокруг связи Свободное вращение Отсутствует свободное вращение Способность к хим.реакциям Низкая высокая
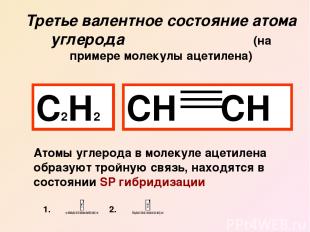
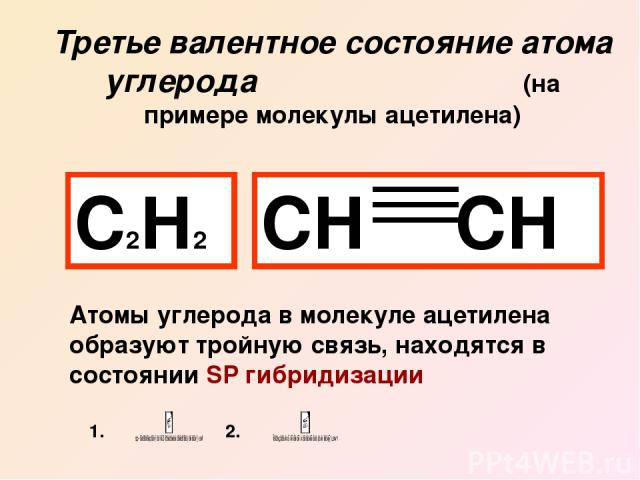
Третье валентное состояние атома углерода (на примере молекулы ацетилена) С2Н2 СН СН Атомы углерода в молекуле ацетилена образуют тройную связь, находятся в состоянии SP гибридизации 1. 2.
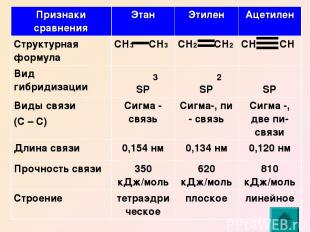
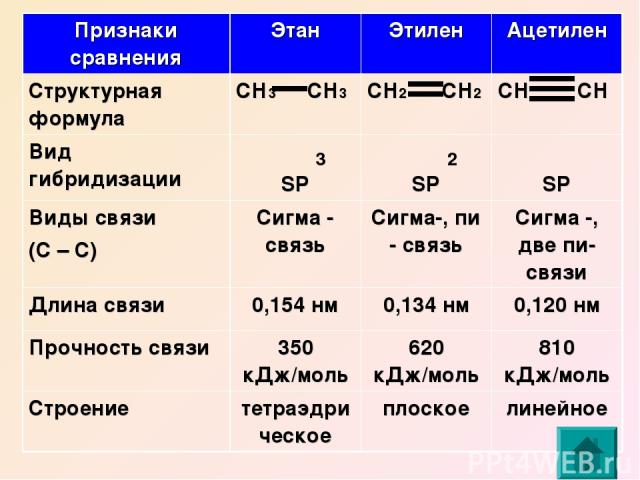
3 2 Признаки сравнения Этан Этилен Ацетилен Структурная формула СН3 СН3 СН2 СН2 СН СН Вид гибридизации SP SP SP Виды связи (С – С) Сигма - связь Сигма-, пи - связь Сигма -, две пи-связи Длина связи 0,154 нм 0,134 нм 0,120 нм Прочность связи 350 кДж/моль 620 кДж/моль 810 кДж/моль Строение тетраэдрическое плоское линейное
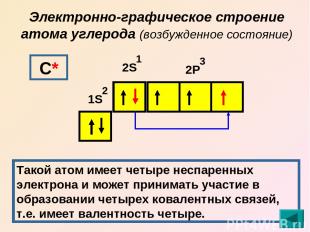
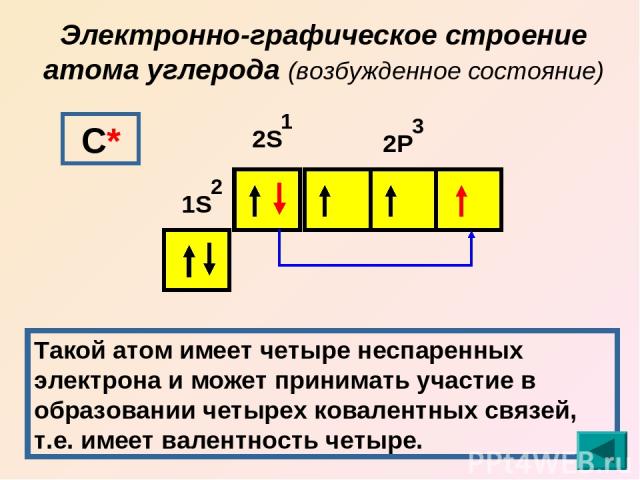
Электронно-графическое строение атома углерода (возбужденное состояние) 1S 2S 2Р 2 1 3 С* Такой атом имеет четыре неспаренных электрона и может принимать участие в образовании четырех ковалентных связей, т.е. имеет валентность четыре.
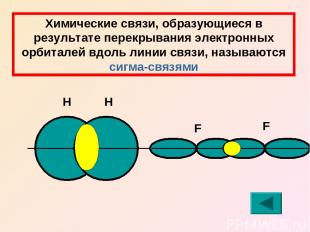
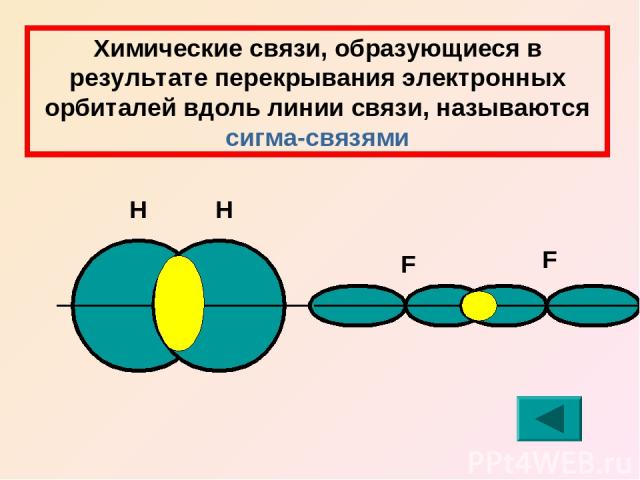
Химические связи, образующиеся в результате перекрывания электронных орбиталей вдоль линии связи, называются сигма-связями Н Н F F
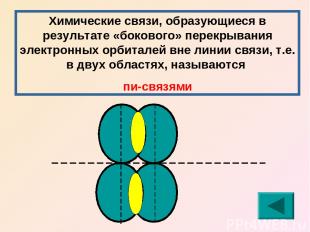
Химические связи, образующиеся в результате «бокового» перекрывания электронных орбиталей вне линии связи, т.е. в двух областях, называются пи-связями