Презентация на тему: Углерод и его свойства

Углерод и его свойства. 9 класс. Учитель Артищева А.М. МОУ СОШ с. Новоалександровка

Выдающийся французский химик, академик Парижской академии наук. В 70-х гг. XVIII в. приступил к решению наиболее важной проблемы химии - изучению процессов горения и дыхания, которые рассматривали тогда с позиции теории флогистона, носителя «горючести» тел. Ученому потребовалось около двух десятков лет напряженной работы, чтобы доказать несовершенство этой теории.
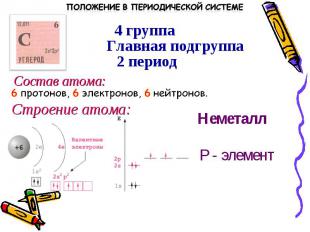
Состав атома:6 протонов, 6 электронов, 6 нейтронов.Строение атома:НеметаллР - элемент
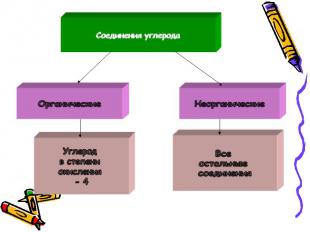
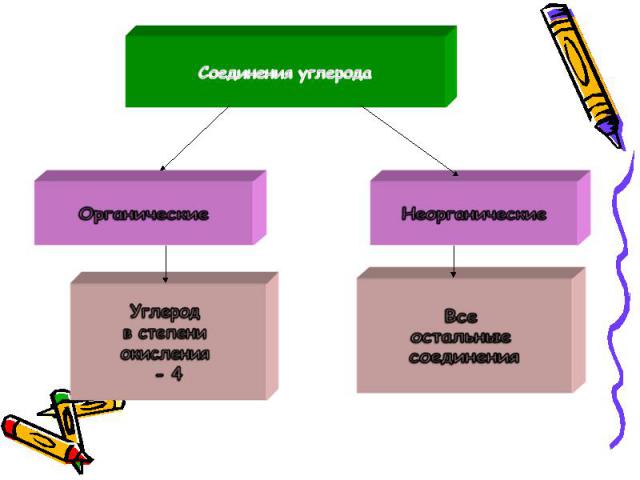
Соединения углерода

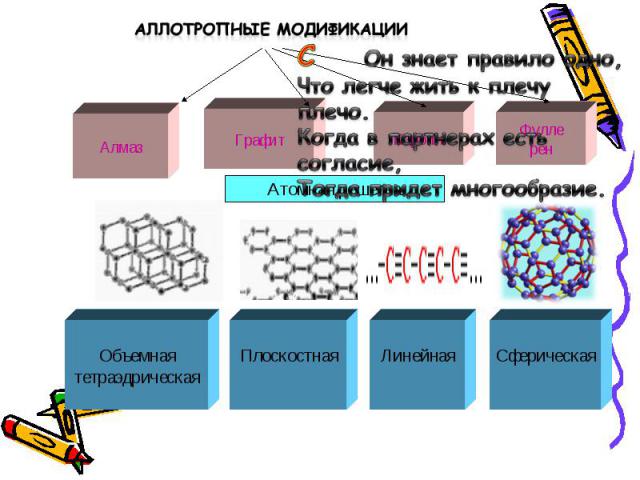
АЛЛОТРОПИЯ - способность атомов одного химического элемента образовывать несколько простых веществ.
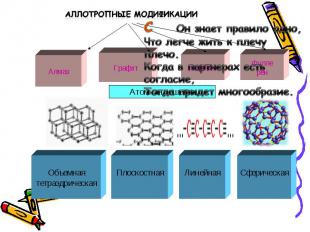

БесцветныйПрозрачныйНе проводит электрический токПрочныйТвердыйОн в чистом виде черный, мрачный,Неплавкий и едва горюч.Бывает как кристалл прозрачный,В котором блещет солнца луч.


Алмаз «ШАХ» 16 век

Изумруд, бриллианты, золото, серебро

Бриллианты, сапфир

Плоский алмаз

Деталь большой императорской короны

Алмаз «Орлов»

Темно-серыйНепрозрачныйПроводит электрический токМягкийМеталлический блеск Оставляет след на бумагеЖирный на ощупьТот элемент в печной трубеНаходим в виде сажиИли в простом карандашеЕго встречаем даже.
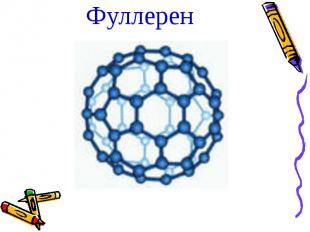
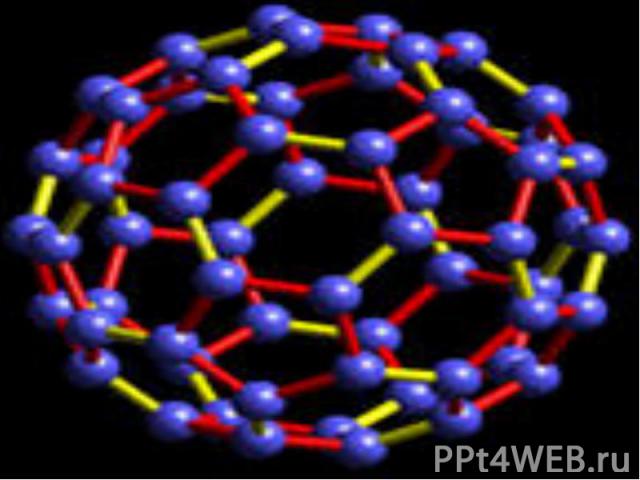
Фуллерен
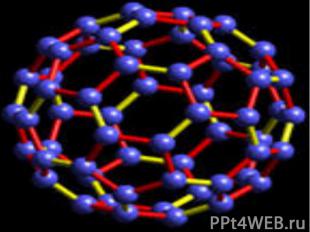
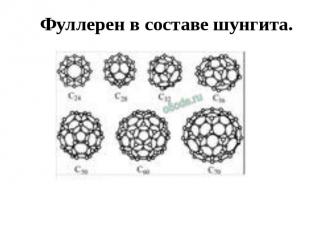
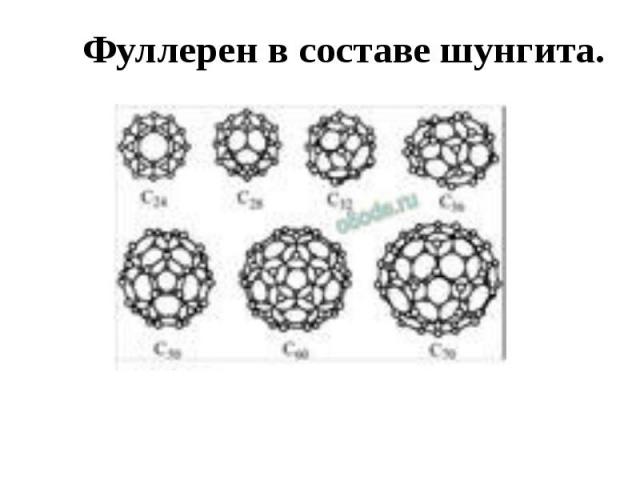
Фуллерен в составе шунгита.
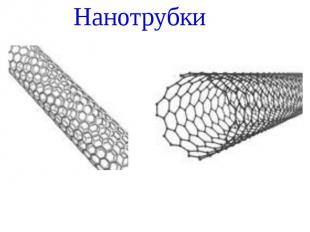
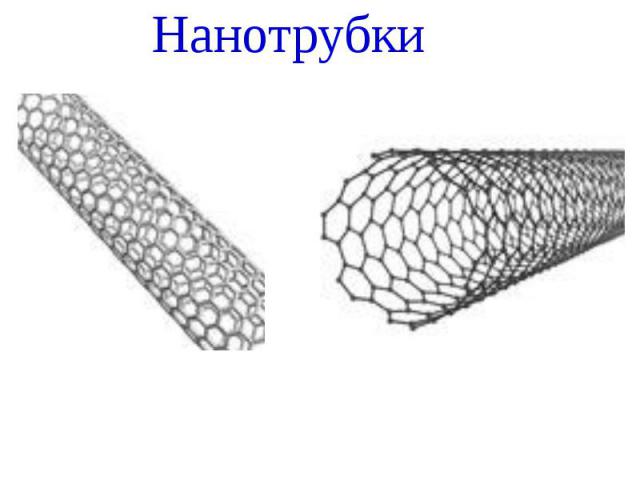
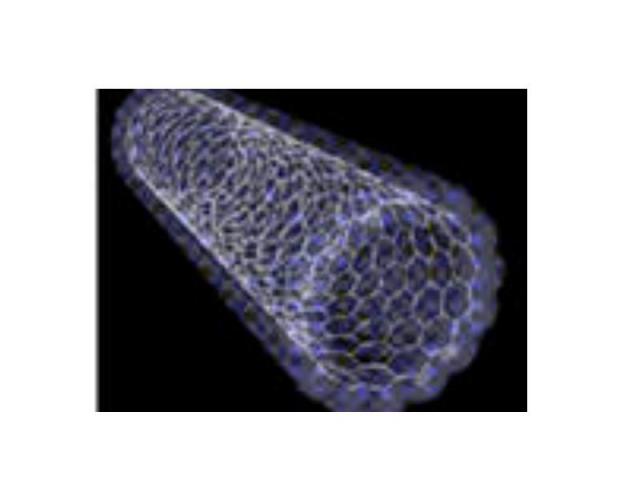
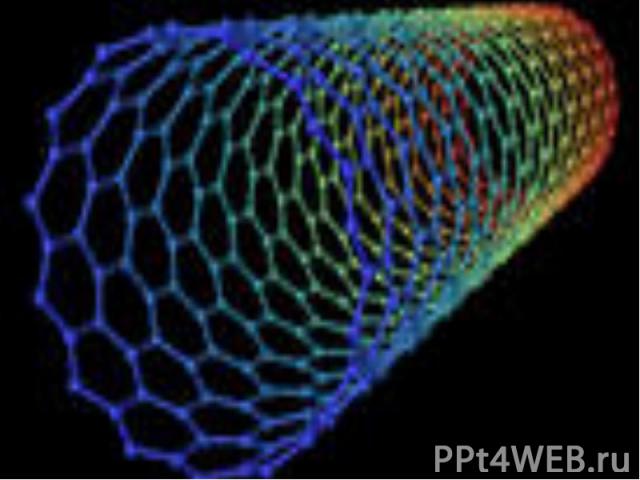
Нанотрубки

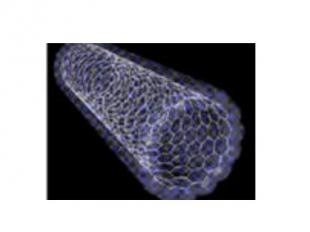
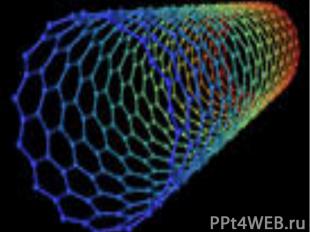

Многослойная нанотрубка

- свойство углерода удерживать на пористой поверхности растворенные вещества и газыНа основе адсорбционных свойств угля разработал фильтрующий противогаз.
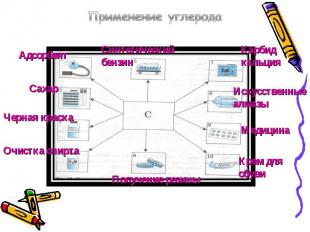
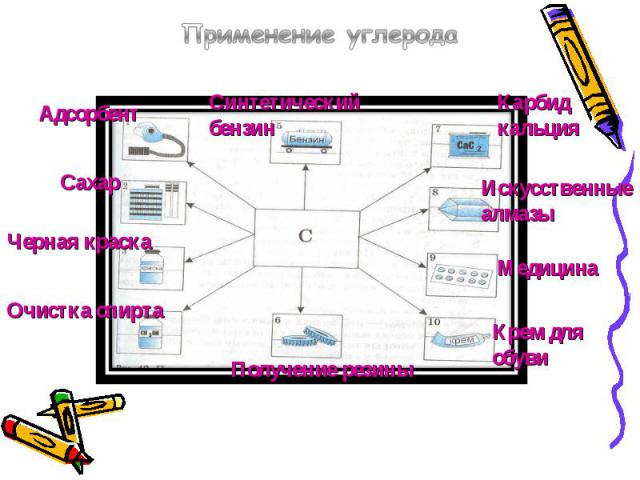
Применение углерода

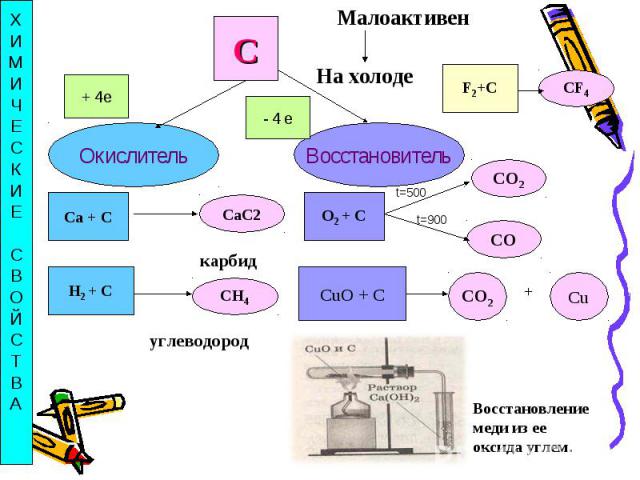
Свойства атомов углерода 1. окислительные – атомы С принимают четыре электрона, приобретают при этом степень окисления -42. восстановительные – атомы С отдают 4 (2) электрона, приобретают при этом степень окисления +4 (+2).

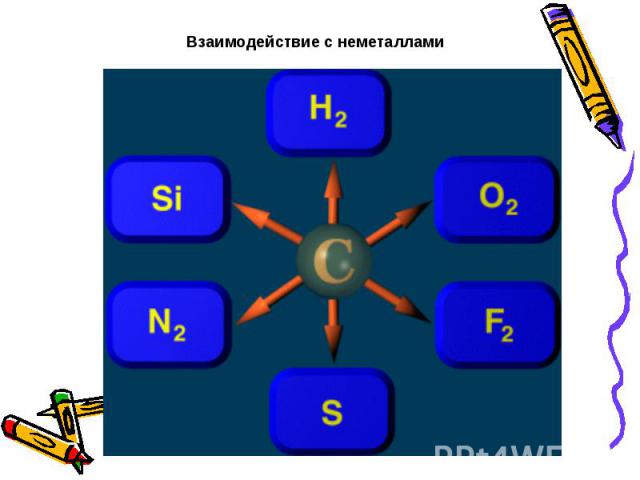
При нагревании углерод соединяется с кислородом, образуя оксид углерода (IV), или углекислый газ:С + O2 = CO2При недостатке кислорода образуется оксид углерода (II), или угарный газ:2С + О2 = 2СОС водородом углерод соединяется только при высоких температурах и в присутствии катализаторов. В зависимости от температуры образуются различные углеводороды, например, метан:С + 2H2 = CH4Углерод взаимодействует при нагревании с серой и фтором, в электрической дуге с азотом: С + 2S = CS2 С + 2F2 = CF4 2С + N2 = (CN)2

Горение угля в кислороде


Углерод — сильный восстановитель. При нагревании с водяным паром он вытесняет из воды водород:Н2O + С = СО + Н2При нагревании углерода с оксидом углерода (IV) образуется угарный газ:С + СО2 = 2СО Углерод восстанавливает многие металлы из их оксидов:2Fe2O3 + 3С = 4Fe + 3CO2С металлами или их оксидами углерод образует карбиды:CaO + 3C = CaC2 + СО
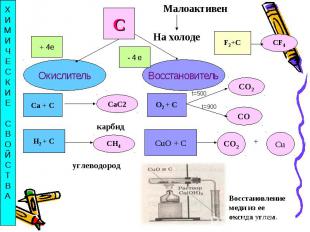
Восстановлениемеди из ее оксида углем.ХИМИЧЕСКИЕСВОЙСТВА
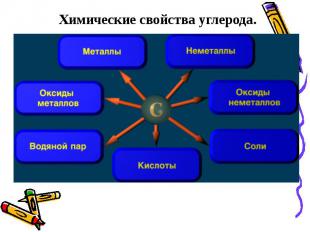
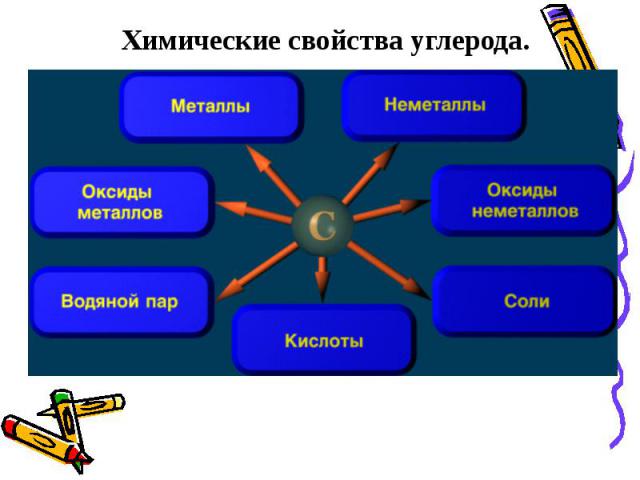
Химические свойства углерода.
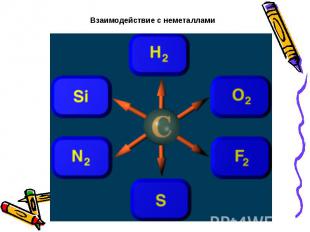
Взаимодействие с неметаллами

Список использованной литературы:О.С. Габриелян «Химия 9 класс» ( М.: Дрофа, 2008), учебник для 9 класса.О.С. Габриелян «Настольная книга учителя химии. 9 класс», М.: «Блик и К0», 2001 год Энциклопедия для детей «Аванта +» «Химия», М.: «Аванта +», 2001 годВ. Малышкина «Занимательная химия. Нескучный учебник», Санкт-Петербург, «Тригон», 2001 год.CD: «Химия–9 («Просвещение»)», мультимедийное учебное пособие нового образца.Иллюстрации : ресурсы сети Интернет; Большая Советская Энциклопедия, 1978 год.