Презентация на тему: Лекции по общей и неорганической химии


Рецензент: д.х.н. Киселев Ю.М. (химический факультет МГУ) Рецензент: д.х.н. Киселев Ю.М. (химический факультет МГУ) Рекомендовано к изданию кафедрой неорганической химии МИТХТ (протокол № 3 от 10.11.2010) Е.В. Савинкина 2010 МИТХТ им. М.В. Ломоносова 2010 Утверждено Библиотечно-издательской комиссией МИТХТ им. М.В.Ломоносова в качестве учебного пособия для студентов 1 курса бакалавриата по направлениям 020100 62 (Химия), 240100 62 (Химическая технология и биотехнология), 150600 62 (Материаловедение и технология новых материалов), 280200 (Защита окружающей среды), 200500 62 (Метрология, стандартизация и сертификация), 080500 (Менеджмент). Один оптический диск Объем данных 0,9 Мб

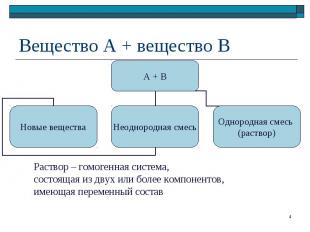

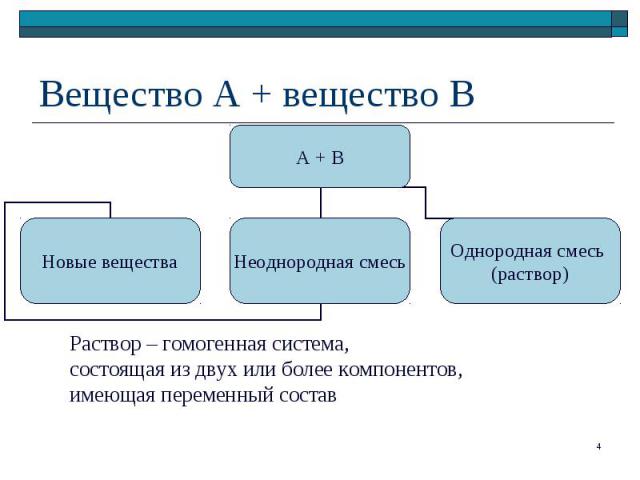
Смеси Смеси Грубодисперсные системы (взвеси) Тонкодисперсные системы (коллоидные системы) Истинные растворы

Дисперсионная среда – газообразная Дисперсионная среда – газообразная Дисперсная фаза: твердая – пыль, дым, порошок жидкая – смог, облако, туман Дисперсионная среда – жидкая Дисперсионная фаза: твердая – суспензия, паста жидкая – эмульсия газообразная – пена, газированная вода Дисперсионная среда – твердая Дисперсная фаза: твердая – горные породы, цветные стекла, композиты жидкая – твердые эмульсии газообразная – твердые пены

Агрегатное состояние: газообразные, жидкие, твердые растворы Агрегатное состояние: газообразные, жидкие, твердые растворы Состав раствора: растворитель + растворенное вещество Параметры раствора: температура, давление, содержание растворенного вещества

Массовая доля Массовая доля Молярная концентрация (молярность) Эквивалентная концентрация (нормальность) Коэффициент растворимости Мольная доля Массовая концентрация Моляльная концентрация (моляльность)

Идеальные Идеальные ΔV = 0; ΔQ = 0 Реальные ΔV ≠ 0 1 л H2O + 1 л C2H5OH → 1,93 л раствора ΔQ ≠ 0 Qрастворение = – Qразрыв связей + Qобразование связей
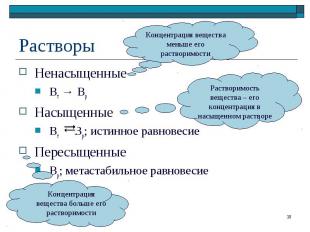
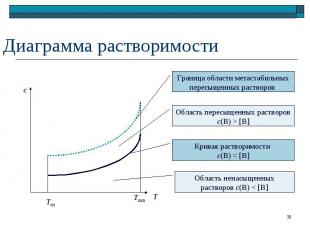
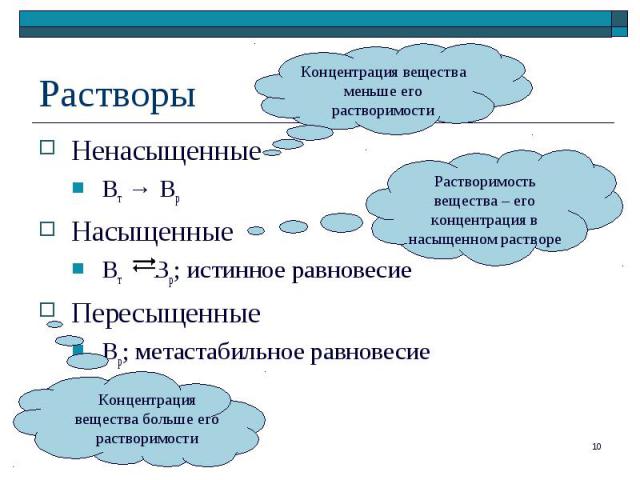
Ненасыщенные Ненасыщенные Вт → Вр Насыщенные Вт Вр; истинное равновесие Пересыщенные Вр; метастабильное равновесие

Если нет химического взаимодействия Если нет химического взаимодействия Ar(г) Ar(р) Влияние давления = 1 0 (принцип Ле Шателье) Увеличение давления → (растворимость увеличивается) Уменьшение давления ← (растворимость уменьшается)

Влияние температуры Влияние температуры Qразрыв связей ≈ 0 Qобразование связей > 0 Процесс экзотермический (принцип Ле Шателье) Уменьшение температуры → (растворимость увеличивается) Увеличение температуры ← (растворимость уменьшается)

Если есть химическое взаимодействие Если есть химическое взаимодействие Cl2(г) Cl2(р) Cl2(р) + 2Н2О Н3О+ + Cl + НClО НClО + Н2О Н3О+ + ClО
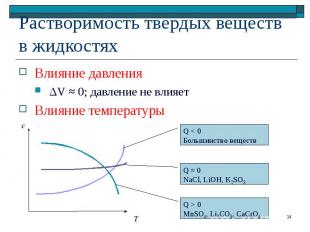
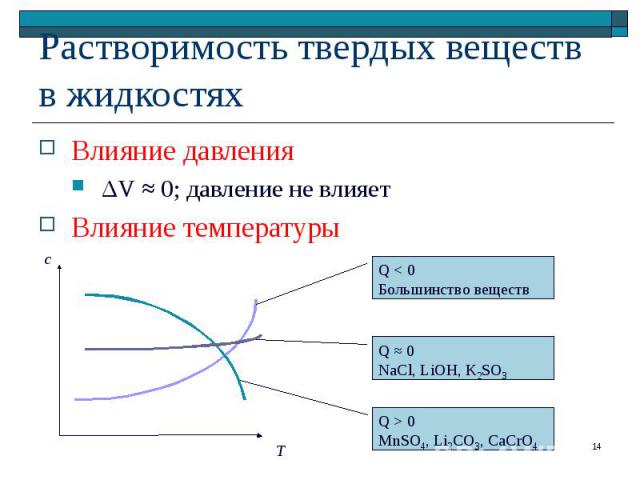
Влияние давления Влияние давления ΔV ≈ 0; давление не влияет Влияние температуры

![MA M+(р) + A–(р) MA M+(р) + A–(р) [MA] = 0, [M+] = [A–] = c0 Степень диссоциации MA M+(р) + A–(р) MA M+(р) + A–(р) [MA] = 0, [M+] = [A–] = c0 Степень диссоциации](https://fs1.ppt4web.ru/images/95606/143206/310/img17.jpg)
MA M+(р) + A–(р) MA M+(р) + A–(р) [MA] = 0, [M+] = [A–] = c0 Степень диссоциации:
![MA MA(р) + M+(р) + A–(р) MA MA(р) + M+(р) + A–(р) [MA] > 0, [M+] = [A–] < MA MA(р) + M+(р) + A–(р) MA MA(р) + M+(р) + A–(р) [MA] > 0, [M+] = [A–] <](https://fs1.ppt4web.ru/images/95606/143206/310/img18.jpg)
MA MA(р) + M+(р) + A–(р) MA MA(р) + M+(р) + A–(р) [MA] > 0, [M+] = [A–] < c0 Степень диссоциации:

MxAy(р) x Ma+(р) + y Ab–(р) MxAy(р) x Ma+(р) + y Ab–(р) Константа диссоциации KD
![МА М+ + А– МА М+ + А– [M+] [A–] KD = ––––––––– [MA] [M+] = [A–] = c0 [MA] = (1 – МА М+ + А– МА М+ + А– [M+] [A–] KD = ––––––––– [MA] [M+] = [A–] = c0 [MA] = (1 –](https://fs1.ppt4web.ru/images/95606/143206/310/img20.jpg)
МА М+ + А– МА М+ + А– [M+] [A–] KD = ––––––––– [MA] [M+] = [A–] = c0 [MA] = (1 – ) c0 KD = 2 c0 / (1 – )

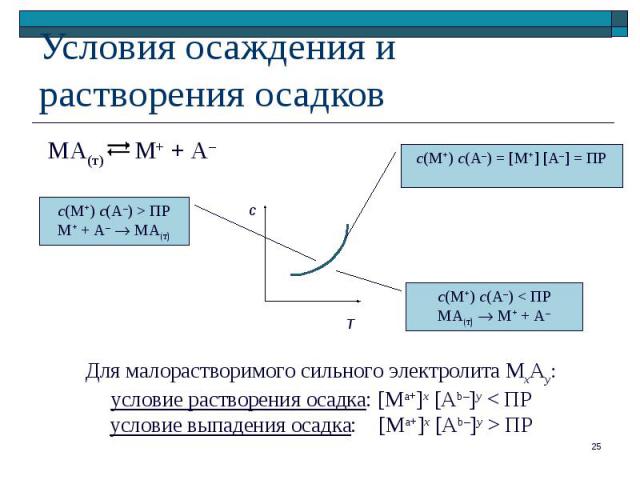
М+ + А– МА(т)
![МхАу(т) х Ма+ + у Аb– МхАу(т) х Ма+ + у Аb– [Ma+] = x L; [Ab–] = y L ПР(МхАу) = МхАу(т) х Ма+ + у Аb– МхАу(т) х Ма+ + у Аb– [Ma+] = x L; [Ab–] = y L ПР(МхАу) =](https://fs1.ppt4web.ru/images/95606/143206/310/img22.jpg)
МхАу(т) х Ма+ + у Аb– МхАу(т) х Ма+ + у Аb– [Ma+] = x L; [Ab–] = y L ПР(МхАу) = (x L)x (y L)y = xx yy Lx+y

Рассчитать растворимость сульфата серебра, если ПР(Ag2SO4) = 1,2 . 10–5 Рассчитать растворимость сульфата серебра, если ПР(Ag2SO4) = 1,2 . 10–5 Ag2SO4(т) 2Ag+ + SO42– L 2L L ПР = [Ag+ ]2 [SO42–] = (2L)2L = 4L3
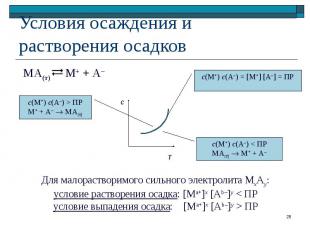

МхАу(т) х Ма+ + у Аb– МхАу(т) х Ма+ + у Аb– Увеличение с(Ма+) или с(Аb–) Сдвиг равновесия в сторону образования осадка

МхАу(т) х Ма+ + у Аb– МхАу(т) х Ма+ + у Аb– Уменьшение с(Ма+) или с(Аb–) Сдвиг равновесия в сторону растворения осадка

Связывание в виде менее растворимого вещества (осадок AgCl осадок AgI) Связывание в виде менее растворимого вещества (осадок AgCl осадок AgI) Связывание в виде комплексного иона (осадок PbSO4 [Pb(OH)4]2–) Перевод в другую форму (осадок BaCrO4 Cr2O72–)

PO43– PO43– Ag2SO4(т) Ag3PO4(т) SO42– 3 Ag2SO4(т) + 2 PO43– 2 Ag3PO4(т) + 3 SO42– (1) KС = [SO42–]3 / [ PO43–]2 ПР1 = [Ag+]2[SO42–] ПР2 = [Ag+]3[ PO43–] (1) = 3(2) – 2(3) KС = (ПР1)3 / (ПР2)2 ~ (10–5)3/(10–18)2 > 1

Условие задачи Условие задачи V(H2O) = ? m(CaSO4.2H2O) = 1 г ПР(CaSO4) = 4.10–5 M(CaSO4.2H2O) = 172 г/моль



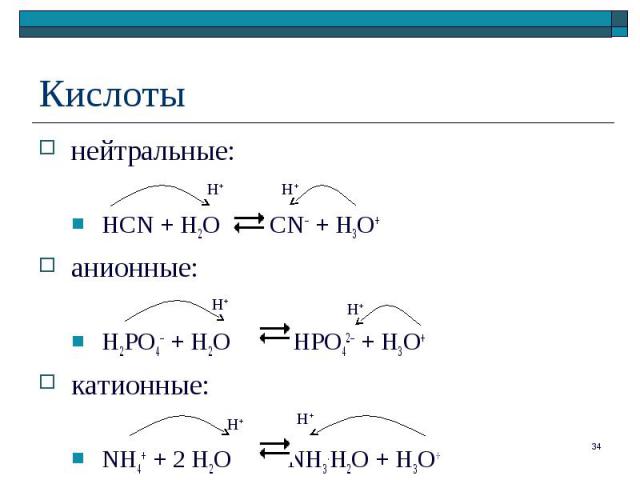
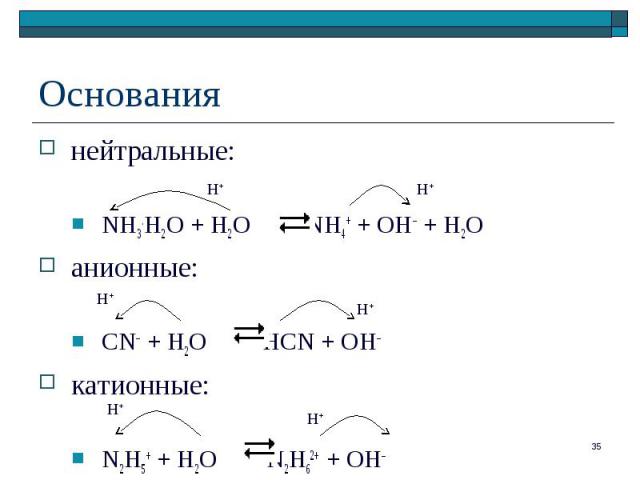
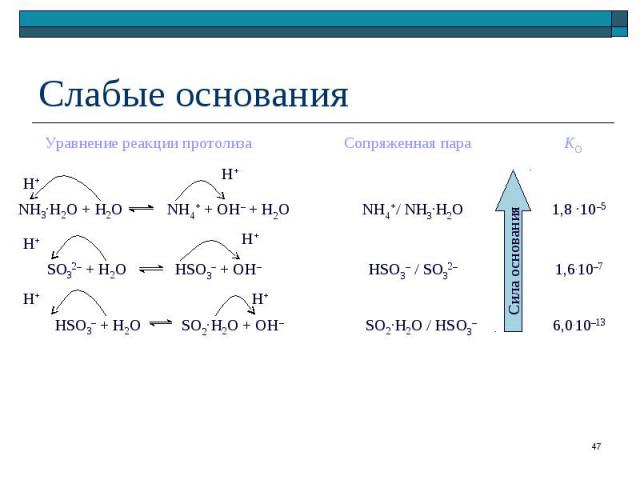
кислотные или основные свойства частиц обусловлены их способностью отдавать или присоединять катион водорода (протон Н+) кислотные или основные свойства частиц обусловлены их способностью отдавать или присоединять катион водорода (протон Н+) NH4+ + S2– NH3 + HS– Кт Ос Ос Кт Пары "сопряженная кислота / сопряженное основание": NH4+/NH3 и HS –/ S2–
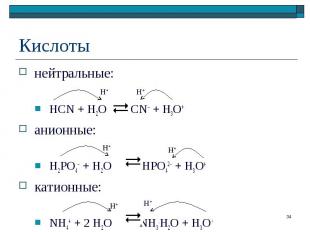
нейтральные: нейтральные: HCN + H2O CN– + H3O+ анионные: H2PO4– + H2O HPO42– + H3O+ катионные: NH4+ + 2 H2O NH3.H2O + H3O+
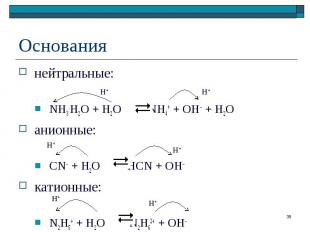
нейтральные: нейтральные: NH3.H2O + H2O NH4+ + OH– + H2O анионные: CN– + H2O HCN + OH– катионные: N2H5+ + H2O N2H62+ + OH–
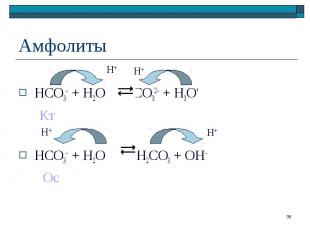
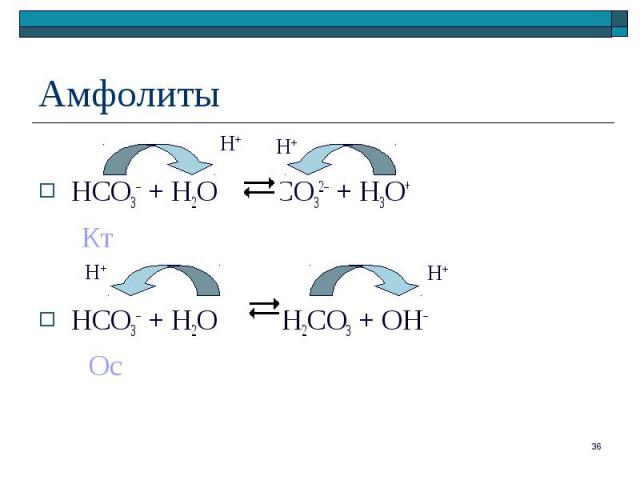
HCO3– + H2O CO32– + H3O+ Кт HCO3– + H2O H2CO3 + OH– Ос

Апротонные: Апротонные: C6H6, CS2, CCl4 Протонные H2O, NH3, C2H5OH (амфолиты)
![H2O + H2O H3O+ + OH– При стандартной температуре 298 К (25 С): KB (Kw) = [H3O+] H2O + H2O H3O+ + OH– При стандартной температуре 298 К (25 С): KB (Kw) = [H3O+]](https://fs1.ppt4web.ru/images/95606/143206/310/img37.jpg)
H2O + H2O H3O+ + OH– При стандартной температуре 298 К (25 С): KB (Kw) = [H3O+] [OH–] = 1.10–14 В чистой воде при 25 С [H3O+] = [OH–] = KB = 10–7 моль/л
![рН = –lg[H3O+] рН = –lg[H3O+] [H3O+] = 10–рН Гидроксидный показатель (рОН) pOH = рН = –lg[H3O+] рН = –lg[H3O+] [H3O+] = 10–рН Гидроксидный показатель (рОН) pOH =](https://fs1.ppt4web.ru/images/95606/143206/310/img38.jpg)
рН = –lg[H3O+] рН = –lg[H3O+] [H3O+] = 10–рН Гидроксидный показатель (рОН) pOH = –lg[OH–] [OH–] = 10–рОН рН + рОН = –lgKB = 14

В чистой воде при 25 С В чистой воде при 25 С рН = рОН = 7 Среда нейтральная Если [H3O+] > 1.10–7, то рН < 7 Среда кислотная Если [OH–] > 1.10–7, то рОН < 7 и pH > 7 Среда щелочная
![При [H3O+] = 0,1 моль/л При [H3O+] = 0,1 моль/л (например, в 0,1 М растворе HCl) При [H3O+] = 0,1 моль/л При [H3O+] = 0,1 моль/л (например, в 0,1 М растворе HCl)](https://fs1.ppt4web.ru/images/95606/143206/310/img40.jpg)
При [H3O+] = 0,1 моль/л При [H3O+] = 0,1 моль/л (например, в 0,1 М растворе HCl) pH = 1 (нижний предел). При [OH–] = 0,1 моль/л (например, в 0,1 М растворе KOH) рН = 13 (верхний предел).

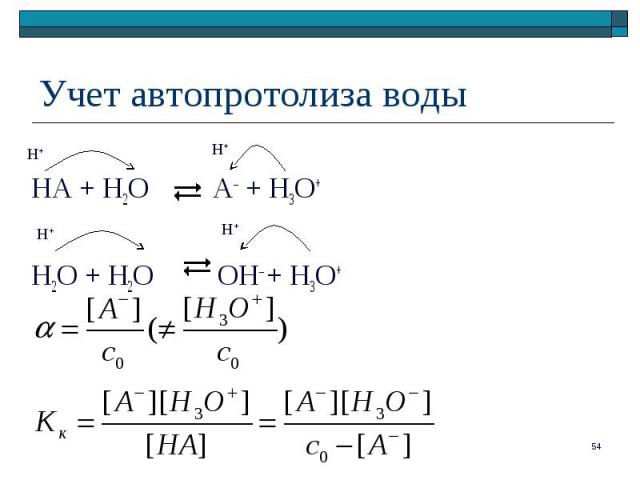
HA + H2O A– + H3O+

Сопряженная пара KК Сопряженная пара KК СН3СООН / СН3СОО– 1,7.10–5 Al3+.H2O / AlOH2+ 9,6.10–6 H2S / HS– 1,1.10–7 B(OH)3.H2O/[B(OH)4]– 5,8.10–10

HA + H2O = A– + H3O+ Бескилородные кислоты: HCl, HBr, HI Кислородсодержащие кислоты состава НхЭОу, если у – х 2 (правило Полинга) Протолиз сильных кислот необратим Анионы сильных кислот являются непротолитами и не участвуют в реакциях протолиза

Уравнение реакции протолиза Сопряженная пара KК Уравнение реакции протолиза Сопряженная пара KК

A– + H2O HA + ОН–


Анионы: Анионы: амид-ион NH2– метилат-ион CH3O– и другие алкоголят-ионы гидроксид-ион ОН– Соединения, дающие эти ионы при диссоциации MOH, где М – щелочной элемент или Tl(I) M(OH)2, где М – Ba, Ra и др.

Ni(OH)2(т) Ni2+ + 2OH— Ni(OH)2(т) Ni2+ + 2OH— Слабое основание? Сильное основание? ПР = [Ni2+][OH—]2


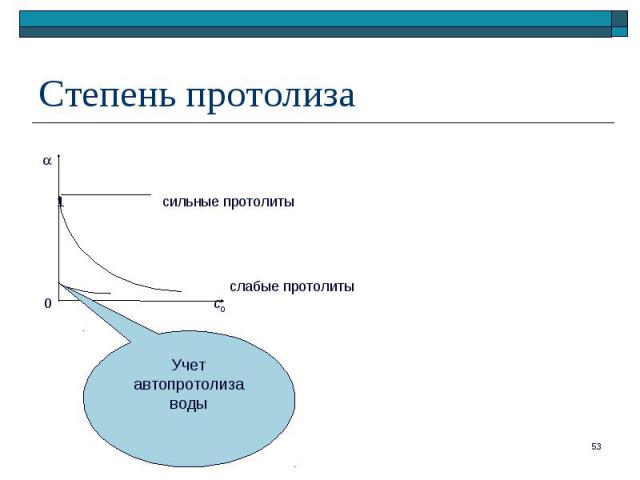
– отношение числа частиц, подвергшихся протолизу, к исходному числу частиц – отношение числа частиц, подвергшихся протолизу, к исходному числу частиц Для реакции протолиза слабой кислоты: HA + H2O A– + H3O+ ([H3O+] = [A–] при отсутствии в растворе других протолитов)

При << 1 ( < 0,05): _____ = Kк / c0
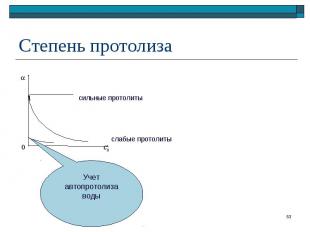

HA + H2O A– + H3O+ H2O + H2O OH– + H3O+
![Kкc0 – Kк[A–] = [A–][H3O+] Kкc0 – Kк[A–] = [A–][H3O+] Kкc0 – Kк[A–] = [A–][H3O+] Kкc0 – Kк[A–] = [A–][H3O+]](https://fs1.ppt4web.ru/images/95606/143206/310/img54.jpg)
Kкc0 – Kк[A–] = [A–][H3O+] Kкc0 – Kк[A–] = [A–][H3O+]
![При бесконечном разбавлении: При бесконечном разбавлении: с0 → 0; [H3O+] → 10–7 При бесконечном разбавлении: При бесконечном разбавлении: с0 → 0; [H3O+] → 10–7](https://fs1.ppt4web.ru/images/95606/143206/310/img55.jpg)
При бесконечном разбавлении: При бесконечном разбавлении: с0 → 0; [H3O+] → 10–7 моль/л при Kк ≥ 10–5 α → 1 при Kк = 10–7 α → 0,5

Изменение концентрации слабого протолита Изменение концентрации слабого протолита закон разбавления Оствальда разбавление Изменение температуры протолиз – эндотермический процесс нагревание Изменение концентрации одноименных ионов принцип Ле Шателье введение одноименных ионов

Протолиз слабой кислоты в присутствии сильной кислоты: Протолиз слабой кислоты в присутствии сильной кислоты: HA + H2O A– + H3O+ = Kк / [H3O+]
![H2SO4 + 2H2O = SO42 + 2H3O+ с0(H2SO4) = 0,001 моль л pH = –lg [H3O+] = – lg(2c0) H2SO4 + 2H2O = SO42 + 2H3O+ с0(H2SO4) = 0,001 моль л pH = –lg [H3O+] = – lg(2c0)](https://fs1.ppt4web.ru/images/95606/143206/310/img58.jpg)
H2SO4 + 2H2O = SO42 + 2H3O+ с0(H2SO4) = 0,001 моль л pH = –lg [H3O+] = – lg(2c0) = – lg (2.10–3) = 2,7
![HNO3 + H2O = NO3– + H3O+ [H3O+] = c0 = 1.10–11 pH = – lg[H3O+] = 11 H2O + H2O H3 HNO3 + H2O = NO3– + H3O+ [H3O+] = c0 = 1.10–11 pH = – lg[H3O+] = 11 H2O + H2O H3](https://fs1.ppt4web.ru/images/95606/143206/310/img59.jpg)
HNO3 + H2O = NO3– + H3O+ [H3O+] = c0 = 1.10–11 pH = – lg[H3O+] = 11 H2O + H2O H3O+ + OH– [H3O+] = 1.10–7 Ответ: рН 7
![HClO + H2O ClO– + Н3O+; Kк = 2,82 . 10–8 [ClO–] = [H3O+]; [HClO] = c0 HClO + H2O ClO– + Н3O+; Kк = 2,82 . 10–8 [ClO–] = [H3O+]; [HClO] = c0](https://fs1.ppt4web.ru/images/95606/143206/310/img60.jpg)
HClO + H2O ClO– + Н3O+; Kк = 2,82 . 10–8 [ClO–] = [H3O+]; [HClO] = c0
![KK = 5,75 . 10–10 KB = 1 . 10–14 [NH4+] = [OH–]; [NH3 . H2O] = c0 KK = 5,75 . 10–10 KB = 1 . 10–14 [NH4+] = [OH–]; [NH3 . H2O] = c0](https://fs1.ppt4web.ru/images/95606/143206/310/img61.jpg)
KK = 5,75 . 10–10 KB = 1 . 10–14 [NH4+] = [OH–]; [NH3 . H2O] = c0


KCl = K+ + Cl– KCl = K+ + Cl– непротолиты Нет гидролиза, нейтральная среда, рН 7 NH4NO3 = NH4+ + NO3– Кт непротолит NH4+ + 2H2O NH3.H2O + H3O+ Гидролиз по катиону, кислотная среда, pH < 7

ZnSO4 = Zn2+ + SO42– ZnSO4 = Zn2+ + SO42– Zn2+.H2O + H2O ZnOH+ + H3O+ Гидролиз по катиону, кислотная среда, рН < 7 KNO2 = K+ + NO2– NO2– + H2O HNO2 + OH– Гидролиз по аниону, щелочная среда, pH > 7

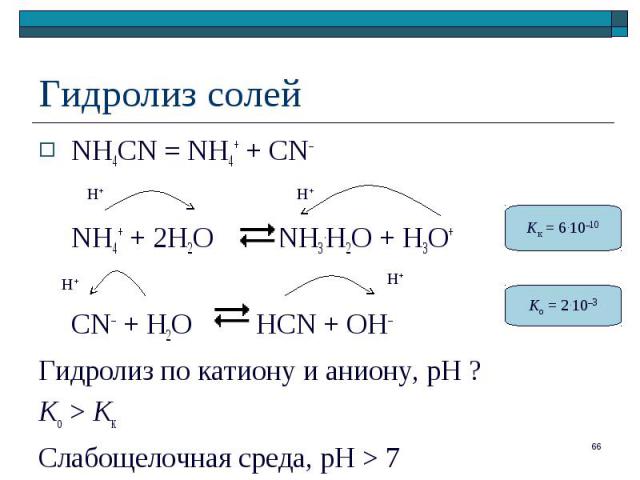
NH4CN = NH4+ + CN– NH4CN = NH4+ + CN– NH4+ + 2H2O NH3.H2O + H3O+ CN– + H2O HCN + OH– Гидролиз по катиону и аниону, рН ? Ko > Kк Слабощелочная среда, pH > 7
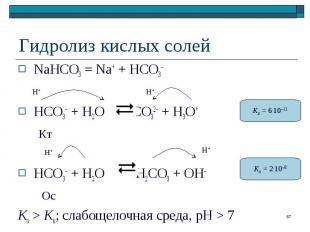
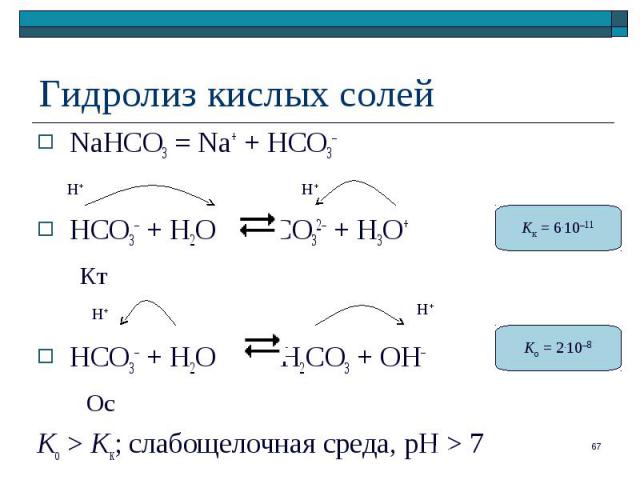
NaHCO3 = Na+ + HCO3– NaHCO3 = Na+ + HCO3– HCO3– + H2O CO32– + H3O+ Кт HCO3– + H2O H2CO3 + OH– Ос Ko > Kк; слабощелочная среда, pH > 7

Усиление (α↑) Усиление (α↑) Повышение температуры Понижение концентрации Связывание одноименных ионов
 + 3HCl(p) PIIICl–I3(ж) + 3H2Oизб. = H2[PHO PIIICl–I3(ж) + 3H2Oизб. = H2[PHO3](p) + 3HCl(p) PIIICl–I3(ж) + 3H2Oизб. = H2[PHO](https://fs1.ppt4web.ru/images/95606/143206/310/img68.jpg)
PIIICl–I3(ж) + 3H2Oизб. = H2[PHO3](p) + 3HCl(p) PIIICl–I3(ж) + 3H2Oизб. = H2[PHO3](p) + 3HCl(p) H2[PHO3] + H2O H[PHO3]– + H3O+ HCl + H2O = Cl– + H3O+ pH < 7

Mg3N + 8H2O = 2NH3.H2O + Mg(OH)2 Mg3N + 8H2O = 2NH3.H2O + Mg(OH)2 NH3·H2O + H2O NH4+ + OH– + H2O Если Mg(OH)2 в осадке: Mg(OH)2(т) Mg2+ + 2OH– Если Mg(OH)2 в растворе: Mg(OH)2 = Mg2+ + 2OH– pH > 7

Al2S3(т) + 6H2O = 2Al(OH)3↓ + 3H2S↑ Al2S3(т) + 6H2O = 2Al(OH)3↓ + 3H2S↑ Совместный гидролиз: 2Al3+ +3S2– + 6H2O = 2Al(OH)3↓ + 3H2S↑

FeCl3 = Fe3+ + 3 Cl– FeCl3 = Fe3+ + 3 Cl– Fe3+.H2O + H2O FeOH2+ + H3O+ [Fe(H2O)6]3+ + H2O [Fe(H2O)5(OH)]2+ + H3O+
![Более строгий подход: Более строгий подход: если считать [Fe3+] = с0(1 – α) 2с0 Более строгий подход: Более строгий подход: если считать [Fe3+] = с0(1 – α) 2с0](https://fs1.ppt4web.ru/images/95606/143206/310/img72.jpg)
Более строгий подход: Более строгий подход: если считать [Fe3+] = с0(1 – α) 2с0 Kк = ––––––––– (1 – )

При с0 = 0,1 моль /л и Kк = 7 10 3 = 0,007: При с0 = 0,1 моль /л и Kк = 7 10 3 = 0,007: 0,007 = 2 0,1 {1 } 0,1 2 + 0,007 0,007 = 0 = 0,23; второй корень отрицательный рH = lg[H3O+] = lg с0 = lg 0,23 0,1 = 1,6

FeCl3 = Fe3+ + 3 Cl– FeCl3 = Fe3+ + 3 Cl– Fe3+.H2O + H2O FeOH2+ + H3O+ Zn + 2H3O+ = Zn2+ + H2 + 2H2O

Na3PO4 = 3 Na+ + PO43– Na3PO4 = 3 Na+ + PO43– PO43– + H2O HPO42– + OH–

Na3PO4 (т) = 3 Na+ + PO43– Na3PO4 (т) = 3 Na+ + PO43– PO43– + H2O HPO42– + OH– Zn + 2H2O + 2OH– = [Zn(OH)4]2– + H2
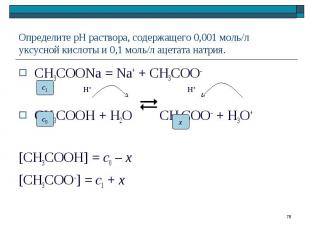
CH3COONa = Na+ + CH3COO– CH3COONa = Na+ + CH3COO– CH3COOH + H2O CH3COO– + Н3О+ [CH3COOH] = c0 – x [CH3COO–] = c1 + x


HA– – амфолит HA– – амфолит (HCO3–, HS–, H2PO4–, HPO42– и т.д.) Диссоциация: NaHA = Na+ + HA– Протолиз иона-амфолита HA– как основания: HA– + H2O H2A + OH–; Kо(H2A/HA–) = Kв/Kк(H2A/HA–) Протолиз иона-амфолита HA– как кислоты: HA– + H2O A2– + H3O+; Kк(HA–/A2–)

Без вывода: Без вывода: рН не зависит от концентрации амфолита

HA– pKк(H2A/HA–) pKк(HA–/A2–) pH HCO3– 6,37 10,33 8,35 HSO3– 1,78 7,20 4,49 HS– 6,98 12,91 9,94 H2PO4– 2,14 7,21 4,68 HPO42– 7,21 12,34 9,78














![MA M+(р) + A–(р) MA M+(р) + A–(р) [MA] = 0, [M+] = [A–] = c0 Степень диссоциации: MA M+(р) + A–(р) MA M+(р) + A–(р) [MA] = 0, [M+] = [A–] = c0 Степень диссоциации:](https://fs1.ppt4web.ru/images/95606/143206/640/img17.jpg)
![MA MA(р) + M+(р) + A–(р) MA MA(р) + M+(р) + A–(р) [MA] > 0, [M+] = [A–] < c0 Степень диссоциации: MA MA(р) + M+(р) + A–(р) MA MA(р) + M+(р) + A–(р) [MA] > 0, [M+] = [A–] < c0 Степень диссоциации:](https://fs1.ppt4web.ru/images/95606/143206/640/img18.jpg)

![МА М+ + А– МА М+ + А– [M+] [A–] KD = ––––––––– [MA] [M+] = [A–] = c0 [MA] = (1 – ) c0 KD = 2 c0 / (1 – ) МА М+ + А– МА М+ + А– [M+] [A–] KD = ––––––––– [MA] [M+] = [A–] = c0 [MA] = (1 – ) c0 KD = 2 c0 / (1 – )](https://fs1.ppt4web.ru/images/95606/143206/640/img20.jpg)

![МхАу(т) х Ма+ + у Аb– МхАу(т) х Ма+ + у Аb– [Ma+] = x L; [Ab–] = y L ПР(МхАу) = (x L)x (y L)y = xx yy Lx+y МхАу(т) х Ма+ + у Аb– МхАу(т) х Ма+ + у Аb– [Ma+] = x L; [Ab–] = y L ПР(МхАу) = (x L)x (y L)y = xx yy Lx+y](https://fs1.ppt4web.ru/images/95606/143206/640/img22.jpg)
![Рассчитать растворимость сульфата серебра, если ПР(Ag2SO4) = 1,2 . 10–5 Рассчитать растворимость сульфата серебра, если ПР(Ag2SO4) = 1,2 . 10–5 Ag2SO4(т) 2Ag+ + SO42– L 2L L ПР = [Ag+ ]2 [SO42–] = (2L)2L = 4L3 Рассчитать растворимость сульфата серебра, если ПР(Ag2SO4) = 1,2 . 10–5 Рассчитать растворимость сульфата серебра, если ПР(Ag2SO4) = 1,2 . 10–5 Ag2SO4(т) 2Ag+ + SO42– L 2L L ПР = [Ag+ ]2 [SO42–] = (2L)2L = 4L3](https://fs1.ppt4web.ru/images/95606/143206/640/img23.jpg)


![Связывание в виде менее растворимого вещества (осадок AgCl осадок AgI) Связывание в виде менее растворимого вещества (осадок AgCl осадок AgI) Связывание в виде комплексного иона (осадок PbSO4 [Pb(OH)4]2–) Перевод в другую форму (осадок BaCrO4 Cr2O72–) Связывание в виде менее растворимого вещества (осадок AgCl осадок AgI) Связывание в виде менее растворимого вещества (осадок AgCl осадок AgI) Связывание в виде комплексного иона (осадок PbSO4 [Pb(OH)4]2–) Перевод в другую форму (осадок BaCrO4 Cr2O72–)](https://fs1.ppt4web.ru/images/95606/143206/640/img27.jpg)
![PO43– PO43– Ag2SO4(т) Ag3PO4(т) SO42– 3 Ag2SO4(т) + 2 PO43– 2 Ag3PO4(т) + 3 SO42– (1) KС = [SO42–]3 / [ PO43–]2 ПР1 = [Ag+]2[SO42–] ПР2 = [Ag+]3[ PO43–] (1) = 3(2) – 2(3) KС = (ПР1)3 / (ПР2)2 ~ (10–5)3/(10–18)2 > 1 PO43– PO43– Ag2SO4(т) Ag3PO4(т) SO42– 3 Ag2SO4(т) + 2 PO43– 2 Ag3PO4(т) + 3 SO42– (1) KС = [SO42–]3 / [ PO43–]2 ПР1 = [Ag+]2[SO42–] ПР2 = [Ag+]3[ PO43–] (1) = 3(2) – 2(3) KС = (ПР1)3 / (ПР2)2 ~ (10–5)3/(10–18)2 > 1](https://fs1.ppt4web.ru/images/95606/143206/640/img28.jpg)





![H2O + H2O H3O+ + OH– При стандартной температуре 298 К (25 С): KB (Kw) = [H3O+] [OH–] = 1.10–14 В чистой воде при 25 С [H3O+] = [OH–] = KB = 10–7 моль/л H2O + H2O H3O+ + OH– При стандартной температуре 298 К (25 С): KB (Kw) = [H3O+] [OH–] = 1.10–14 В чистой воде при 25 С [H3O+] = [OH–] = KB = 10–7 моль/л](https://fs1.ppt4web.ru/images/95606/143206/640/img37.jpg)
![рН = –lg[H3O+] рН = –lg[H3O+] [H3O+] = 10–рН Гидроксидный показатель (рОН) pOH = –lg[OH–] [OH–] = 10–рОН рН + рОН = –lgKB = 14 рН = –lg[H3O+] рН = –lg[H3O+] [H3O+] = 10–рН Гидроксидный показатель (рОН) pOH = –lg[OH–] [OH–] = 10–рОН рН + рОН = –lgKB = 14](https://fs1.ppt4web.ru/images/95606/143206/640/img38.jpg)
![В чистой воде при 25 С В чистой воде при 25 С рН = рОН = 7 Среда нейтральная Если [H3O+] > 1.10–7, то рН < 7 Среда кислотная Если [OH–] > 1.10–7, то рОН < 7 и pH > 7 Среда щелочная В чистой воде при 25 С В чистой воде при 25 С рН = рОН = 7 Среда нейтральная Если [H3O+] > 1.10–7, то рН < 7 Среда кислотная Если [OH–] > 1.10–7, то рОН < 7 и pH > 7 Среда щелочная](https://fs1.ppt4web.ru/images/95606/143206/640/img39.jpg)
![При [H3O+] = 0,1 моль/л При [H3O+] = 0,1 моль/л (например, в 0,1 М растворе HCl) pH = 1 (нижний предел). При [OH–] = 0,1 моль/л (например, в 0,1 М растворе KOH) рН = 13 (верхний предел). При [H3O+] = 0,1 моль/л При [H3O+] = 0,1 моль/л (например, в 0,1 М растворе HCl) pH = 1 (нижний предел). При [OH–] = 0,1 моль/л (например, в 0,1 М растворе KOH) рН = 13 (верхний предел).](https://fs1.ppt4web.ru/images/95606/143206/640/img40.jpg)

![Сопряженная пара KК Сопряженная пара KК СН3СООН / СН3СОО– 1,7.10–5 Al3+.H2O / AlOH2+ 9,6.10–6 H2S / HS– 1,1.10–7 B(OH)3.H2O/[B(OH)4]– 5,8.10–10 Сопряженная пара KК Сопряженная пара KК СН3СООН / СН3СОО– 1,7.10–5 Al3+.H2O / AlOH2+ 9,6.10–6 H2S / HS– 1,1.10–7 B(OH)3.H2O/[B(OH)4]– 5,8.10–10](https://fs1.ppt4web.ru/images/95606/143206/640/img42.jpg)




![Ni(OH)2(т) Ni2+ + 2OH— Ni(OH)2(т) Ni2+ + 2OH— Слабое основание? Сильное основание? ПР = [Ni2+][OH—]2 Ni(OH)2(т) Ni2+ + 2OH— Ni(OH)2(т) Ni2+ + 2OH— Слабое основание? Сильное основание? ПР = [Ni2+][OH—]2](https://fs1.ppt4web.ru/images/95606/143206/640/img48.jpg)

![– отношение числа частиц, подвергшихся протолизу, к исходному числу частиц – отношение числа частиц, подвергшихся протолизу, к исходному числу частиц Для реакции протолиза слабой кислоты: HA + H2O A– + H3O+ ([H3O+] = [A–] при отсутствии в растворе д… – отношение числа частиц, подвергшихся протолизу, к исходному числу частиц – отношение числа частиц, подвергшихся протолизу, к исходному числу частиц Для реакции протолиза слабой кислоты: HA + H2O A– + H3O+ ([H3O+] = [A–] при отсутствии в растворе д…](https://fs1.ppt4web.ru/images/95606/143206/640/img50.jpg)

![Kкc0 – Kк[A–] = [A–][H3O+] Kкc0 – Kк[A–] = [A–][H3O+] Kкc0 – Kк[A–] = [A–][H3O+] Kкc0 – Kк[A–] = [A–][H3O+]](https://fs1.ppt4web.ru/images/95606/143206/640/img54.jpg)
![При бесконечном разбавлении: При бесконечном разбавлении: с0 → 0; [H3O+] → 10–7 моль/л при Kк ≥ 10–5 α → 1 при Kк = 10–7 α → 0,5 При бесконечном разбавлении: При бесконечном разбавлении: с0 → 0; [H3O+] → 10–7 моль/л при Kк ≥ 10–5 α → 1 при Kк = 10–7 α → 0,5](https://fs1.ppt4web.ru/images/95606/143206/640/img55.jpg)

![Протолиз слабой кислоты в присутствии сильной кислоты: Протолиз слабой кислоты в присутствии сильной кислоты: HA + H2O A– + H3O+ = Kк / [H3O+] Протолиз слабой кислоты в присутствии сильной кислоты: Протолиз слабой кислоты в присутствии сильной кислоты: HA + H2O A– + H3O+ = Kк / [H3O+]](https://fs1.ppt4web.ru/images/95606/143206/640/img57.jpg)
![H2SO4 + 2H2O = SO42 + 2H3O+ с0(H2SO4) = 0,001 моль л pH = –lg [H3O+] = – lg(2c0) = – lg (2.10–3) = 2,7 H2SO4 + 2H2O = SO42 + 2H3O+ с0(H2SO4) = 0,001 моль л pH = –lg [H3O+] = – lg(2c0) = – lg (2.10–3) = 2,7](https://fs1.ppt4web.ru/images/95606/143206/640/img58.jpg)
![HNO3 + H2O = NO3– + H3O+ [H3O+] = c0 = 1.10–11 pH = – lg[H3O+] = 11 H2O + H2O H3O+ + OH– [H3O+] = 1.10–7 Ответ: рН 7 HNO3 + H2O = NO3– + H3O+ [H3O+] = c0 = 1.10–11 pH = – lg[H3O+] = 11 H2O + H2O H3O+ + OH– [H3O+] = 1.10–7 Ответ: рН 7](https://fs1.ppt4web.ru/images/95606/143206/640/img59.jpg)
![HClO + H2O ClO– + Н3O+; Kк = 2,82 . 10–8 [ClO–] = [H3O+]; [HClO] = c0 HClO + H2O ClO– + Н3O+; Kк = 2,82 . 10–8 [ClO–] = [H3O+]; [HClO] = c0](https://fs1.ppt4web.ru/images/95606/143206/640/img60.jpg)
![KK = 5,75 . 10–10 KB = 1 . 10–14 [NH4+] = [OH–]; [NH3 . H2O] = c0 KK = 5,75 . 10–10 KB = 1 . 10–14 [NH4+] = [OH–]; [NH3 . H2O] = c0](https://fs1.ppt4web.ru/images/95606/143206/640/img61.jpg)




 + 3HCl(p) PIIICl–I3(ж) + 3H2Oизб. = H2[PHO3](p) + 3HCl(p) H2[PHO3] + H2O H[PHO3]– + H3O+ HCl + H2O = Cl– + H3O+ pH < 7 PIIICl–I3(ж) + 3H2Oизб. = H2[PHO3](p) + 3HCl(p) PIIICl–I3(ж) + 3H2Oизб. = H2[PHO3](p) + 3HCl(p) H2[PHO3] + H2O H[PHO3]– + H3O+ HCl + H2O = Cl– + H3O+ pH < 7](https://fs1.ppt4web.ru/images/95606/143206/640/img68.jpg)


![FeCl3 = Fe3+ + 3 Cl– FeCl3 = Fe3+ + 3 Cl– Fe3+.H2O + H2O FeOH2+ + H3O+ [Fe(H2O)6]3+ + H2O [Fe(H2O)5(OH)]2+ + H3O+ FeCl3 = Fe3+ + 3 Cl– FeCl3 = Fe3+ + 3 Cl– Fe3+.H2O + H2O FeOH2+ + H3O+ [Fe(H2O)6]3+ + H2O [Fe(H2O)5(OH)]2+ + H3O+](https://fs1.ppt4web.ru/images/95606/143206/640/img71.jpg)
![Более строгий подход: Более строгий подход: если считать [Fe3+] = с0(1 – α) 2с0 Kк = ––––––––– (1 – ) Более строгий подход: Более строгий подход: если считать [Fe3+] = с0(1 – α) 2с0 Kк = ––––––––– (1 – )](https://fs1.ppt4web.ru/images/95606/143206/640/img72.jpg)
![При с0 = 0,1 моль /л и Kк = 7 10 3 = 0,007: При с0 = 0,1 моль /л и Kк = 7 10 3 = 0,007: 0,007 = 2 0,1 {1 } 0,1 2 + 0,007 0,007 = 0 = 0,23; второй корень отрицательный рH = lg[H3O+] = lg с0 = lg 0,23 0,1 = 1,6 При с0 = 0,1 моль /л и Kк = 7 10 3 = 0,007: При с0 = 0,1 моль /л и Kк = 7 10 3 = 0,007: 0,007 = 2 0,1 {1 } 0,1 2 + 0,007 0,007 = 0 = 0,23; второй корень отрицательный рH = lg[H3O+] = lg с0 = lg 0,23 0,1 = 1,6](https://fs1.ppt4web.ru/images/95606/143206/640/img73.jpg)


![Na3PO4 (т) = 3 Na+ + PO43– Na3PO4 (т) = 3 Na+ + PO43– PO43– + H2O HPO42– + OH– Zn + 2H2O + 2OH– = [Zn(OH)4]2– + H2 Na3PO4 (т) = 3 Na+ + PO43– Na3PO4 (т) = 3 Na+ + PO43– PO43– + H2O HPO42– + OH– Zn + 2H2O + 2OH– = [Zn(OH)4]2– + H2](https://fs1.ppt4web.ru/images/95606/143206/640/img76.jpg)
![CH3COONa = Na+ + CH3COO– CH3COONa = Na+ + CH3COO– CH3COOH + H2O CH3COO– + Н3О+ [CH3COOH] = c0 – x [CH3COO–] = c1 + x CH3COONa = Na+ + CH3COO– CH3COONa = Na+ + CH3COO– CH3COOH + H2O CH3COO– + Н3О+ [CH3COOH] = c0 – x [CH3COO–] = c1 + x](https://fs1.ppt4web.ru/images/95606/143206/640/img77.jpg)