Презентация на тему: Bor


В природе - 6•10-4 В природе - 6•10-4 Входит в состав более 80 минералов Наиболее известный – турмалин Соединения известны более 1000лет Первое используемое соединение – бура – Na2B4O7 • H2O Является одним из пяти важнейших микроэлементов, ускоряет созревание семян, повышает урожайность

Впервые выделен в 1836 г. Ж Гей-Люссак и Л. Тенар Впервые выделен в 1836 г. Ж Гей-Люссак и Л. Тенар Изотопов – 6, в природе – 2 Электронная формула – 1s22s2p1 Возможно состояние sp2 Степени окисления - 0, +3 Еi =8,3 эв (804,8 КДж/моль)

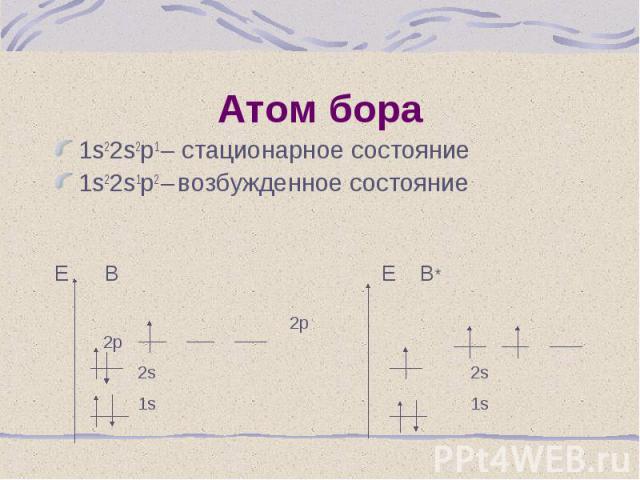
1s22s2p1 – стационарное состояние 1s22s2p1 – стационарное состояние 1s22s1p2 – возбужденное состояние Е В Е В* 2р 2р 2s 2s 1s 1s

Валентное состояние – sp2 (1s+2p=3sp2) атом плоский, < = 1200

Формула - Вn Формула - Вn Твердое вещество. Нет единого мнения о числе модификаций Обычно содержит примеси. Модификации бора резко различаются по свойствам из-за содержания примесей, которые не удаляются Кристаллический бор – черного цвета tпл. =23000С, tкип. ~25500С, диамагнетик, полупроводник Аморфный бор – цвет меняется от бурого до черного, температуры плавления и кипения колеблются около 2300 и 30000С Чистый бор по прочности не уступает алмазу

Металлотермия: Металлотермия: B2O3 + 3Mg = 2B +3MgO полученный бор быстро промывают в растворах щелочи, соляной и плавиковой кислот, хранить в инертной атмосфере Восстановление из галогенидов: BCl3 + 3H2 = 2B + 6HCl Наиболее чистый – термическим разложением бромида бора на танталовой проволоке при 15000С

Инертен, при обычных условиях взаимодействует только со фтором(?) Инертен, при обычных условиях взаимодействует только со фтором(?) При нагревании до 400-7000С – с хлором, серой, азотом, кислородом, восстановитель (?) С водородом не взаимодействует При сильном нагревании восстановительная активность проявляется по отношению к оксидам (кремния, фосфора, углерода, водорода) (?) Горячие концентрированные кислоты (азотная, серная, «царская водка») переводят бор в кислоту Н3ВО3 (?) При сплавлении со щелочами в присутствии окислителя образует бораты 2B+2NaOH+NaClO3=2NaBO2+NaCl+H2O

Бораны – аналоги силанов Бораны – аналоги силанов ВН3 – при обычных условиях не существует, т.к. нет возможности образования делокализованной π –связи Стабилизация возникает при сочетании молекул: В4Н10 , В5Н9, В6Н10, В10Н14 Получаются действием кислот на бориды металлов Бораны – соединения с дефицитом электронов, окислители, сгорают в выделением большого количества теплоты (~2000 КДж/моль) Взаимодействуют с водой Используются в качестве ракетного топлива Имеют неприятный запах, ядовиты В промышленности диборан получают восстановлением при 180оС:
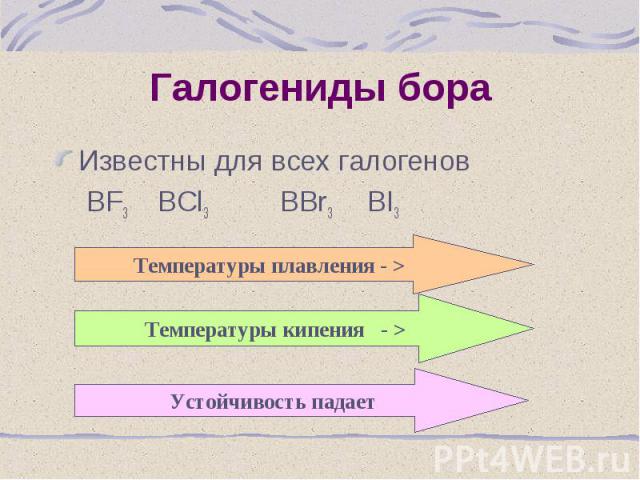
Известны для всех галогенов Известны для всех галогенов BF3 BCl3 BBr3 BI3

Ковалентные молекулярные соединения Ковалентные молекулярные соединения Акцепторы электронов, активно присоединяют воду, аммиак, эфир, спирт С водой и аммиаком образуют гидраты и аммиакаты: BF3•H2O, BF3•NH3 В продуктах присоединения атомы бора находятся в состоянии sp3 Имеют кислотный характер, при гидролизе образуют кислоты Могут быть получены как прямым синтезом, так и из оксида и других соединений бора Применяются в органическом синтезе как катализаторы

В2О3 – существует в виде нескольких модификаций В2О3 – существует в виде нескольких модификаций Аморфная: атомы бора находятся внутри равностороннего треугольника ВО3, sp2-гибридизация Кристаллическая: атомы бора находятся внутри тетраэдра ВО4, связанных в спиральные цепи, sp3-гибридизация. Расположение треугольников и тетраэдров может быть различно

Кристаллический оксид, tпл.=4500С, tкип.=22500С Кристаллический оксид, tпл.=4500С, tкип.=22500С Переходит в стеклообразное состояние, трудно кристаллизуется Типичный кислотный оксид, ангидрид борной кислоты: В2О3 + 3Н2О = 2Н3ВО3

Метаборная кислота – НВО2 Метаборная кислота – НВО2 Ортоборная кислота – Н3ВО3 Пироборная кислота – Н2В4О7 При нагревании теряют воду и превращаются в оксид бора: Н3ВО3 НВО2 Н2В4О7 В2О3 Ортоборная, борная кислота – слабая, одноосновная, проявление кислотных свойств – присоединение ОН-: В(ОН)3 + Н-ОН = [В(ОН)4] +Н+ Все кислоты существуют в полимерном состоянии за счет образования водородных связей

Na2B4O7 – перборат натрия, самая распространенная соль, широко используется Na2B4O7 – перборат натрия, самая распространенная соль, широко используется При сплавлении с солями металлов образуются перлы – окрашенные стекловидные материалы Добавки к стеклу повышают термостойкость и химическую стойкость Безводные бораты получают сплавлением оксида бора с соответсвующим оксидом металла Растворимы только соли щелочных металов

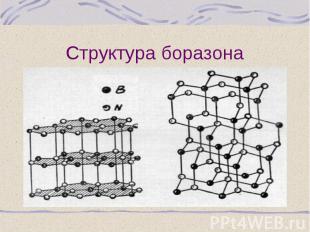
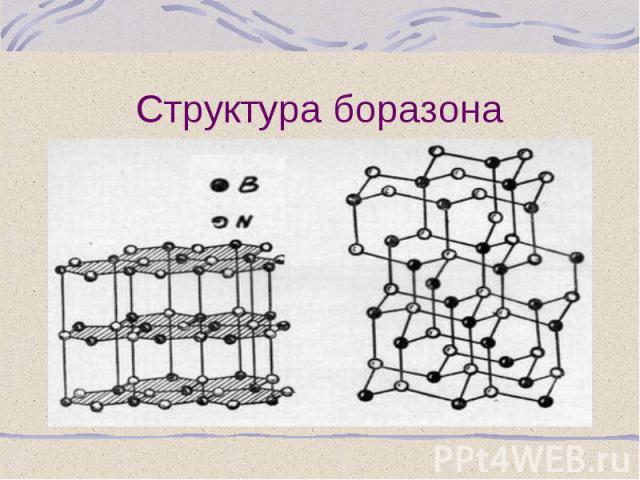
Нитрид бора – ВN – «белый графит», синтезируют из бора или его оксида в присутствии С или Mg как катализатора Нитрид бора – ВN – «белый графит», синтезируют из бора или его оксида в присутствии С или Mg как катализатора При нагревании до 13500С под давлением образует алмазоподобную структуру – боразон, по твердости равен алмазу Устойчив до 20000С (алмаз – до 8500С) Боразол – B3 N3 H6, бесцветная жидкость, по структуре и свойствам близок к бензолу, температуры плавления и кипения соответственно –560С и 550С