Презентация на тему: АЛЮМИНИЙ


Алюмосиликаты: Алюмосиликаты: Глина – Al2O3*nSiO2*mH2O Бокситы – Al2O3*nH2O
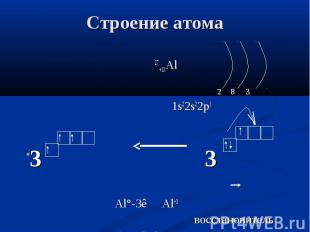
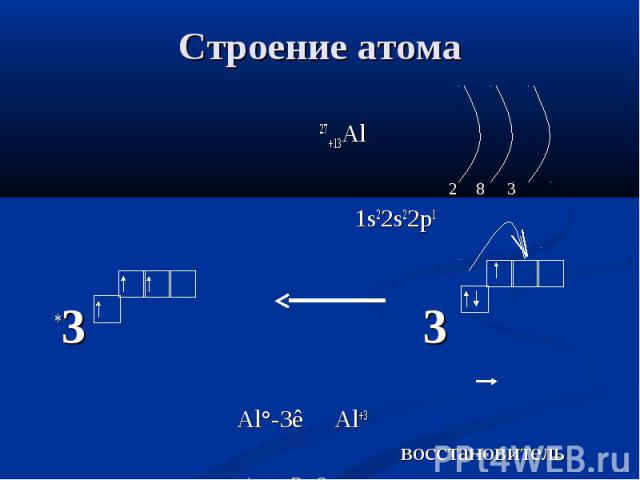
27+13Al 27+13Al 2 8 3 1s22s22p1 *3 3 Al°-3ê Al+3 восстановитель с/о=+3, 0

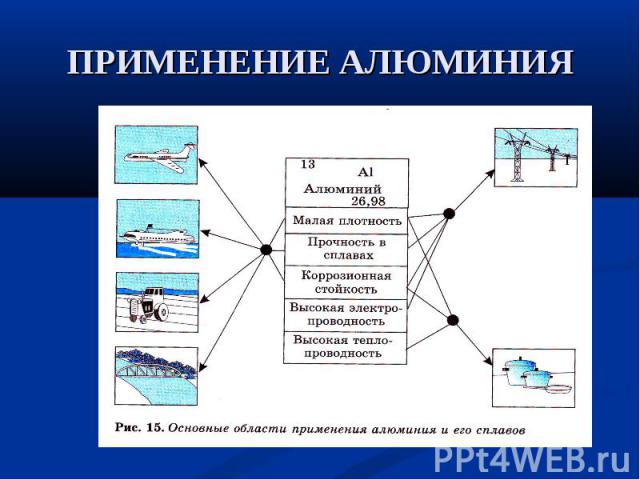
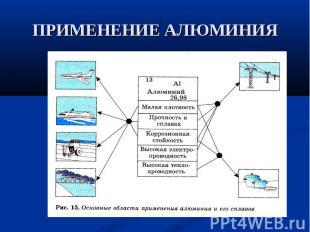
Al-серебристо-белый металл Al-серебристо-белый металл Мягкий, пластичный (легко вытягивается в проволоку и раскатывается в листы), легкий (плотность 2,7г/см3) Хорошо проводит тепло и электрический ток Температура плавления - 660°С Особо чистый Аl хорошо отражает солнечные лучи

Al – активный металл. На воздухе всегда покрыт пленкой Al2O3. Поэтому при обычных условиях не вступает во взаимодействие с другими веществами. Al – активный металл. На воздухе всегда покрыт пленкой Al2O3. Поэтому при обычных условиях не вступает во взаимодействие с другими веществами.

При нагревании При нагревании Взаимодействие с углеродом: 4Al+3C=Al4C3 (1500-1700°C) Взаимодействие с серой: 2Al+3S= Al2S3 (150-170°C)

Взаимодействие с водой (очищенный от оксидной пленки) Взаимодействие с водой (очищенный от оксидной пленки) Al +H2O=Al(OH)3 +H2 Подберите коэффициенты

Взаимодействие с водой (очищенный от оксидной пленки) Взаимодействие с водой (очищенный от оксидной пленки) 2 Al +6H2O=2Al(OH)3 +3H2 Взаимодействует с растворами кислот Al +HCl= AlCl3 + H2 Подберите коэффициенты

Взаимодействие с водой (очищенный от оксидной пленки) Взаимодействие с водой (очищенный от оксидной пленки) 2 Al +6H2O=2Al(OH)3 +3H2 Взаимодействует с растворами кислот 2Al +6HCl= 2AlCl3 + 3H2 Взаимодействует с растворами щелочей Al+ NaOH + H2O=Na[Al(OH)4]+H2 тетрагидроксоалюминат натрия Подберите коэффициенты

Взаимодействие с водой (очищенный от оксидной пленки) Взаимодействие с водой (очищенный от оксидной пленки) 2 Al +6H2O=2Al(OH)3 +3H2 Взаимодействует с растворами кислот 2Al +6HCl= 2AlCl3 + 3H2 Взаимодействует с растворами щелочей 2Al+ 2NaOH + 6H2O=2Na[Al(OH)4]+3H2 тетрагидроксоалюминат натрия



§ 13 (до соединений алюминия) § 13 (до соединений алюминия) Работа с текстом конспекта Подберите коэффициенты методом электронного баланса: Al + H2SO4= Al2(SO4)3 + SO2 + H2O Al + HNO3 = Al(NO3)3 + NO2 + H2O