Презентация на тему: Алюминий






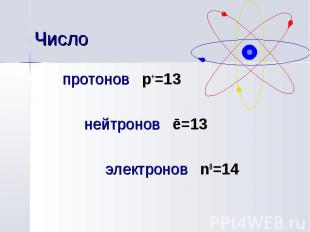
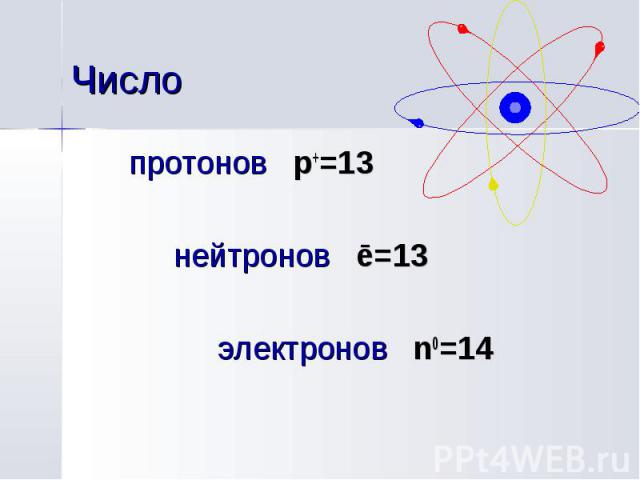
протонов p+=13 протонов p+=13 нейтронов ē=13 электронов n0=14

В природе представлен лишь один стабильный изотоп 27Al. Искусственно получен ряд радиоактивных изотопов алюминия, наиболее долгоживущий 26Al имеет период полураспада 720 тысяч лет. В природе представлен лишь один стабильный изотоп 27Al. Искусственно получен ряд радиоактивных изотопов алюминия, наиболее долгоживущий 26Al имеет период полураспада 720 тысяч лет.
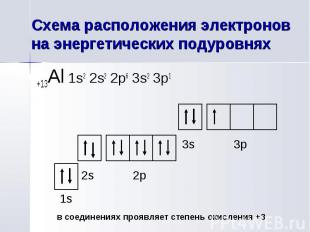
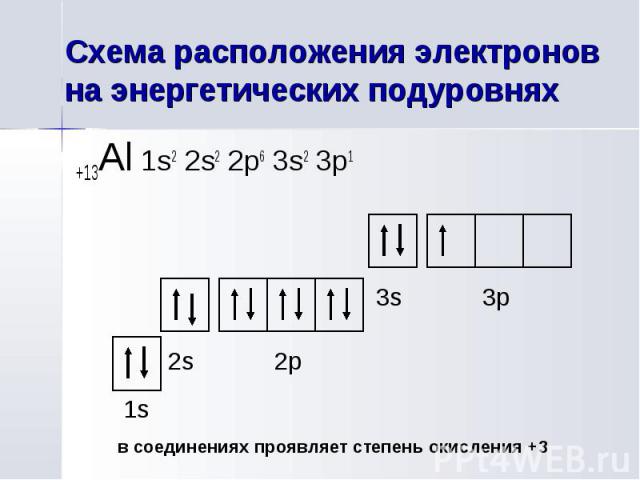
+13Al 1s2 2s2 2p6 3s2 3p1 +13Al 1s2 2s2 2p6 3s2 3p1

Главное квантовое число n=3 Главное квантовое число n=3 Орбитальное квантовое число l=1 Магнитное квантовое число ml=-1 Спиновое квантовое число ms=+½

Схема образования вещества Схема образования вещества Al 0- 3ē Al+3 Тип химической связи -металлическая Тип кристаллической решетки – кубическая гранецентрированная

Al – серебристо-белый металл, пластичный, легкий, хорошо проводит тепло и электрический ток, обладает хорошей ковкостью, легко поддаётся обработке, образует лёгкие и прочные сплавы. Al – серебристо-белый металл, пластичный, легкий, хорошо проводит тепло и электрический ток, обладает хорошей ковкостью, легко поддаётся обработке, образует лёгкие и прочные сплавы. =2,7 г/см3 tпл.=6600С

Al активный металл восстанавливает все элементы, находящиеся справа от него в электрохимическом ряду напряжения металлов, простые вещества – неметаллы. Из сложных соединений алюминий восстанавливает ионы водорода и ионы менее активных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, поскольку его поверхность покрыта защитной оксидной плёнкой Al2 O3 Al активный металл восстанавливает все элементы, находящиеся справа от него в электрохимическом ряду напряжения металлов, простые вещества – неметаллы. Из сложных соединений алюминий восстанавливает ионы водорода и ионы менее активных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, поскольку его поверхность покрыта защитной оксидной плёнкой Al2 O3

1. 2Al+3O2 = 2Al2O3 + O – покрывается пленкой оксида, но в мелкораздроблен-ном виде горит с выделением большого количества теплоты. 1. 2Al+3O2 = 2Al2O3 + O – покрывается пленкой оксида, но в мелкораздроблен-ном виде горит с выделением большого количества теплоты. 2. 2Al + 3Cl2 = 2 AlCl3 (Br2, I3) – на холоду 3. 2Al + 3S = Al2S3 - при нагревании 4. 4Al + 3С = Al4С3 - при нагревании 5. Алюминотермия – получение металлов: Fe, Cr, Mn, Ti, W и другие, например: 3Al + 3Fe3O4 = 4Al2O3 + 9Fe

Алюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6), электролизом расплава AlCl3 (расходуется около 16 кВт·час на 1 кг Al) Алюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6), электролизом расплава AlCl3 (расходуется около 16 кВт·час на 1 кг Al) Электролиз: Al2O3 при 9500С в расплаве криолита: На катоде: Al3+ + 3e = Al0 На угольном аноде (расходуется в процессе электролиза): O2- - 2e = 00; C + O = CO; 2CO + O2 = 2CO2;
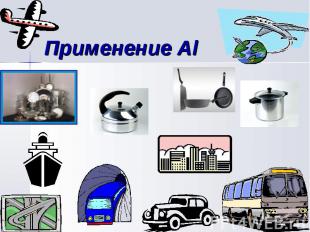

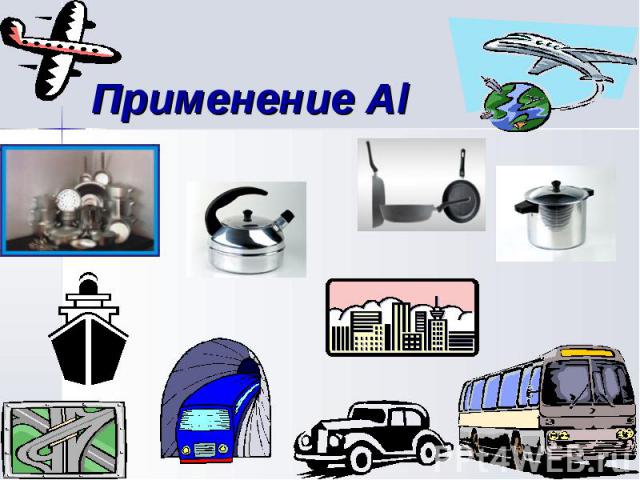
Алюминий – самый распространенный металл земной коры. Его ресурсы практически неисчерпаемы. Алюминий – самый распространенный металл земной коры. Его ресурсы практически неисчерпаемы. Обладает высокой коррозионной стойкостью и практически не нуждается в специальной защите. Высокая химическая активность алюминия используется в алюминотермии. Малая плотность в сочетании с высокой прочностью и пластичностью его сплавов делает алюминий незаменимым конструкционным материалом в самолетостроений и способствует расширению его применения в наземном и водном транспорте, а также в строительстве. Относительно высокая электропроводность позволяет заменять им значительно более дорогую медь в электротехнике.

Очень твердый (корунд, рубин) порошок белого цвета, тугоплавкий - 20500С. Не растворяется в воде. Очень твердый (корунд, рубин) порошок белого цвета, тугоплавкий - 20500С. Не растворяется в воде. Амфотерный оксид, взаимодействует: а) с кислотами Al2O3 + 6H+ = 2Al3+ + 3H2O б) со щелочами Al2O3 + 2OH- = 2AlO-2 + H2O Образуется: а) при окислении или горении алюминия на воздухе 4Al + 3O2 = 2Al2O3 б) в реакции алюминотермии 2Al + Fe2O3 = Al2O3 + 2Fe в) при термическом разложении гидроксида алюминия 2Al (OH)3 = Al2O3 + 3H2O

Белый нерастворимый в воде порошок. Белый нерастворимый в воде порошок. Проявляет амфотерные свойства, взаимодействует: а) с кислотами Al (OH)3 + 3HCl = AlCl3 + 3H2O б) со щелочами Al (OH)3 + Na OH = NaAlO2 + 2H2O Разлагается при нагревании 2Al (OH)3 = Al2O3 + 3H2O Образуется: а) при взаимодействии растворов солей алюминия с растворами щелочей (без избытка) Al3+ + 3OH- = Al (OH)3 б) при взаимодействии алюминатов с кислотами (без избытка) AlO-2 + H+ + H2O = Al (OH)3

Почти все загрязняющие вещества, которые первоначально попали в атмосферу, в конечном итоге оказываются на поверхности суши и воды. Оседающие аэрозоли могут содержать ядовитые тяжелые металлы – свинец, кадмий, ртуть, медь, ванадий, кобальт, никель. Обычно они малоподвижны и накапливаются в почве. Но в почву попадают с дождями также кислоты. Соединяясь с ними, металлы могут переходить в растворимые соединения, доступные растениям. В растворимые формы переходят также вещества, постоянно присутствующие в почвах, что иногда приводит к гибели растений. Примером может служить весьма распространенный в почвах алюминий, растворимые соединения которого поглощаются корнями деревьев. Алюминиевая болезнь, при которой нарушается структура тканей растений, оказывается для деревьев смертельной. Почти все загрязняющие вещества, которые первоначально попали в атмосферу, в конечном итоге оказываются на поверхности суши и воды. Оседающие аэрозоли могут содержать ядовитые тяжелые металлы – свинец, кадмий, ртуть, медь, ванадий, кобальт, никель. Обычно они малоподвижны и накапливаются в почве. Но в почву попадают с дождями также кислоты. Соединяясь с ними, металлы могут переходить в растворимые соединения, доступные растениям. В растворимые формы переходят также вещества, постоянно присутствующие в почвах, что иногда приводит к гибели растений. Примером может служить весьма распространенный в почвах алюминий, растворимые соединения которого поглощаются корнями деревьев. Алюминиевая болезнь, при которой нарушается структура тканей растений, оказывается для деревьев смертельной.

Вывод: Обладая такими свойствами как лёгкость, прочность, коррозионноустойчивость, устойчивость к действию сильных химических реагентов - алюминий нашёл большое значение в авиационном и космическом транспорте, применение во многих отраслях народного хозяйства. Особое место занял алюминий и его сплавы в электротехнике, а за ними будущее нашей науки и техники. Вывод: Обладая такими свойствами как лёгкость, прочность, коррозионноустойчивость, устойчивость к действию сильных химических реагентов - алюминий нашёл большое значение в авиационном и космическом транспорте, применение во многих отраслях народного хозяйства. Особое место занял алюминий и его сплавы в электротехнике, а за ними будущее нашей науки и техники.