Презентация на тему: «Строение атома» 11 класс

Строение атома Опыты Резерфорда Урок физики в 11 классе Подготовила и провела учитель физики Дубиляс Н.Ю. 5klass.net

Цель: расширить знания учащихся по теме, доказать ядерную модель атома с помощью опытов Резерфорда.

Актуализация знаний Что вам известно о строении вещества? Как мы узнаем о строении вещества? Каково строение атома? Как можно узнать о строении атома? Имеет ли ядро атома внутреннюю структуру? Что такое электрон? Входят ли электроны в состав ядра?

Гипотеза о том, что вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий назад. Позиция Демокрита: «Существует предел деления – атом». Позиция Аристотеля: « Делимость вещества бесконечна».

Конкретные представления о строении атома развивались по мере накопления физикой фактов о свойствах вещества. 1897 г - Дж. Дж. Томсон доказал существование электрона, измерил его заряд и массу. 1897 г - В. Вебер впервые высказал мысль об электронном строении атома ( электроны входят в состав атома). 1905 г - Ф. Линдеман утверждал, что атом кислорода имеет форму кольца, а атом серы- форму лепешки. 1903-1904 гг - Дж. Дж. Томсон предложил модель атома в виде положительно заряженного шара, в котором «плавают» электроны.

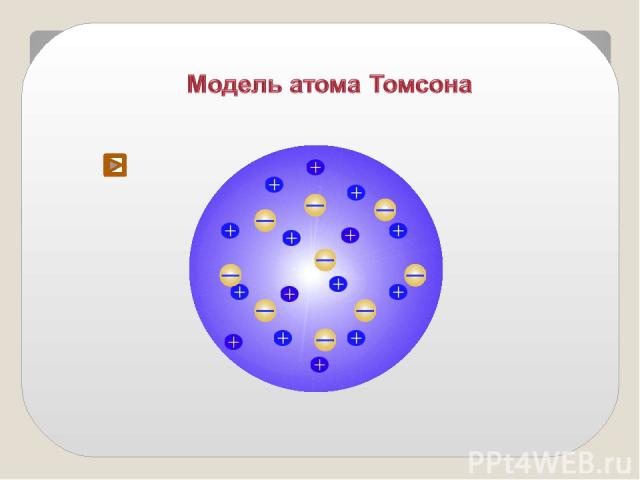
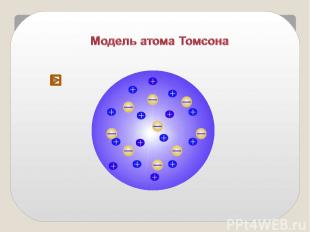
Модель строения атома Томсона Атом – шар, по всему объёму которого равномерно распределён положительный заряд. Внутри шара находятся электроны. Каждый электрон может совершать колебательные движения около своего положения равновесия. Положительный заряд шара равен по модулю суммарному заряду электронов, поэтому заряд атома в целом равен нулю.

Модель Томсона нуждалась в экспериментальной проверке. Важно было убедиться, действительно ли положительный заряд распределён по всему объёму атома с постоянной плотностью. В 1909г. Эрнест Резерфорд совместно со своими сотрудниками Г. Гейгером и Э. Марсденом провёл ряд опытов по исследованию состава и строения атомов.

В 1899 г. открыл альфа - и бета-лучи. Вместе с Ф. Содди в 1903 г. разработал теорию радиоактивного распада и установил закон радиоактивных превращений. В 1903 г. доказал, что альфа-лучи состоят из положительно заряженных частиц. Предсказал существование трансурановых элементов. В 1908 г. ему была присуждена Нобелевская премия. Резерфорд Эрнест (1871–1937) – английский физик, основоположник ядерной физики. Его исследования посвящены атомной и ядерной физике, радиоактивности. Своими фундаментальными открытиями в этих областях заложил основы современного учения о радиоактивности и теории строения атома.

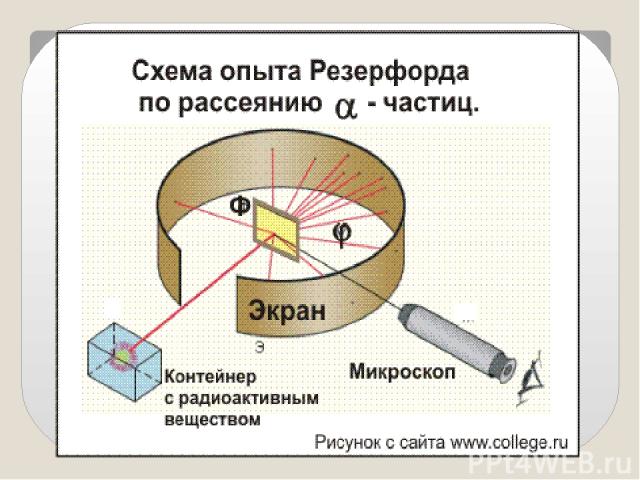
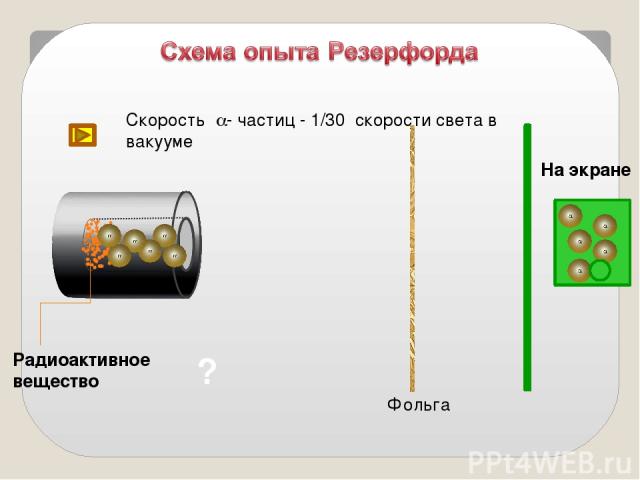
Идея опыта Резерфорда: Зондировать атом альфа–частицами. Альфа-частицы возникают при распаде радия. Масса альфа-частицы в 8000 раз больше массы электрона. Электрический заряд альфа-частицы в 2 раза больше заряда электрона. Скорость альфа-частицы около 15 000 км/с. Альфа-частица является ядром атома гелия.
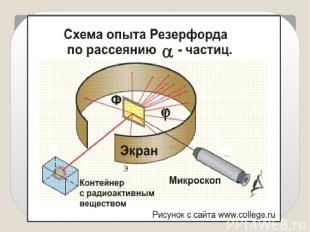

? Фольга Радиоактивное вещество Скорость a- частиц - 1/30 скорости света в вакууме На экране
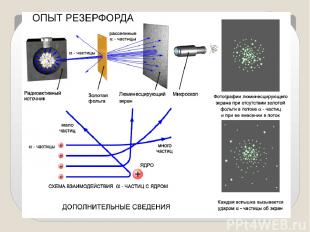

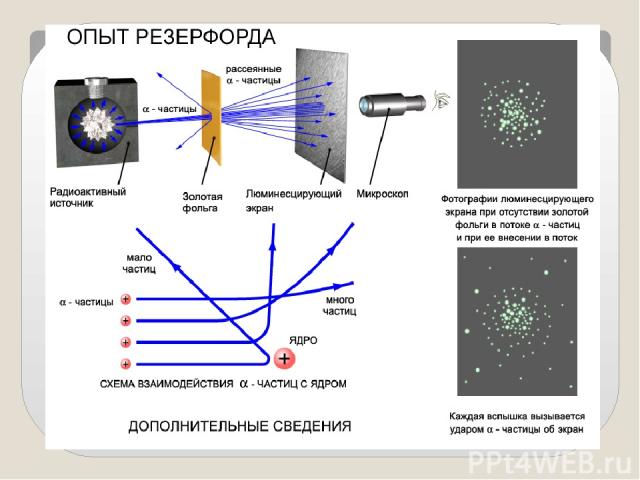
Опыты показали: Подавляющая часть альфа-частиц проходит сквозь фольгу практически без отклонения или с отклонением на малые углы; Некоторая небольшая часть альфа-частиц при прохождении через фольгу отклоняется на значительные углы ( 90,120,150 градусов);

Обнаружилось, что некоторые α-частицы отклонялись на большие углы, до 180º. Резерфорд понял, что такое отклонение возможно лишь при встрече с положительно заряженной частицей большой массы. Малая вероятность отклонения на большие углы говорила о том, что эта положительная частица имеет малые размеры, порядка 10–14 м. Электроны, по Резерфорду, движутся вокруг ядра. Оказалось, что радиус ядра R (10 14 ÷ 10 15)м и зависит от числа нуклонов в ядре.

Выводы из опытов: Положительный заряд сосредоточен в малой части атома – ядре; Практически вся масса атома сосредоточена в этом ядре; Отклонения альфа-частиц на большие углы происходят в результате столкновения альфа – частиц с ядром одного из атомов; Теоретические расчеты позволили оценить размеры ядер атомов – порядка 10-14 м, тогда как размеры атома в 10 000 раз больше.

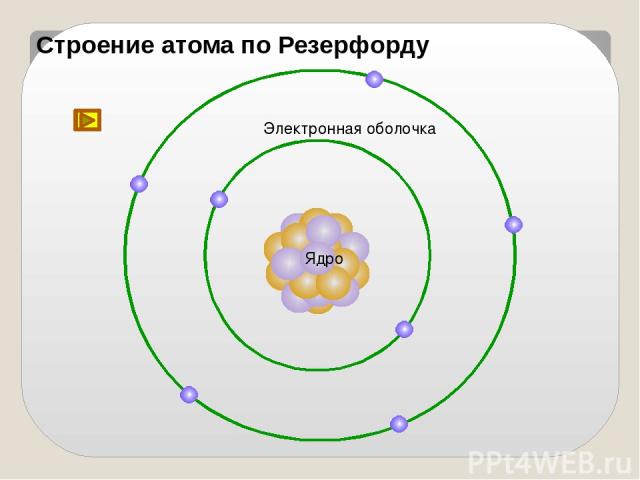
Конец ХIХ - начало ХХ века На основе выводов из опытов Резерфордом была предложена планетарная модель атома
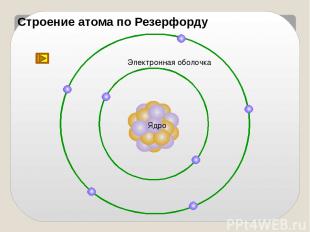
Строение атома по Резерфорду Ядро Электронная оболочка

Недостатки атома Резерфорда Эта модель не согласуется с наблюдаемой стабильностью атомов. По законам классической электродинамики вращающийся вокруг ядра электрон должен непрерывно излучать электромагнитные волны, а поэтому терять свою энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него. Эта модель не объясняет наблюдаемые на опыте оптические спектры атомов. Оптические спектры атомов не непрерывны, как это следует из теории Резерфорда, а состоят из узких спектральных линий, т.е. атомы излучают и поглощают электромагнитные волны лишь определенных частот, характерных для данного химического элемента. К явлениям атомных масштабов законы классической физики неприменимы.

Попыткой спасения планетарной модели атома стали постулаты Нильса Бора

Вопросы на закрепление: 1. В чём заключается сущность модели Томсона? 2. В чём заключалась идея опыта Резерфорда? 3. Объясните по схеме опыт Резерфорда по рассеиванию альфа-частиц. 4. Объясните причину рассеивания альфа-частиц атомами вещества. 5. В чём сущность планетарной модели атома? 6. В чем противоречивость модели атома Резерфорда?

Желаю удачи в изучении физики!