Презентация на тему: Молекулярные основы

Молекулярная физика 900igr.net

Молекулярная физика Основы мкт Температура и энергия теплового движения молекул Уравнение состояния идеального газа Взаимные превращения жидкостей и газов Твердые тела Основы термодинамики

Основы мкт Молекулярно-кинетическая теория Масса и размеры молекул Количество вещества Строение газов, жидкостей и твердых тел Идеальный газ Среднее значение квадрата скорости молекул Основное уравнение мкт

Температура и энергия теплового движения молекул Температура и тепловое равновесие Определение температуры Температура – мера средней кинетической энергии молекул Скорости молекул

Уравнение состояния идеального газа Уравнение Менделеева-Клапейрона Газовые законы Изотермический процесс Изобарный процесс Изохорный процесс

Взаимные превращения жидкостей и газов Насыщенный пар Испарение и кипение Влажность воздуха Измерение влажности

Твердые тела Закон Гука Кристаллические тела Аморфные тела

Основы термодинамики Внутренняя энергия Работа в термодинамике Количество теплоты Первый закон термодинамики и его применение к различным процессам Тепловые двигатели

Молекулярно-кинетическая теория МКТ объясняет свойства макроскопических тел и тепловых процессов, на основе представлений о том, что все тела состоят из отдельных, беспорядочно движущихся частиц. Макроскопические тела – тела, состоящие из большого количества частиц. Микроскопические тела – тела, состоящие из малого количества частиц.

Основные положения мкт Вещество состоит из частиц Частицы непрерывно и хаотически движутся Частицы взаимодействуют друг с другом
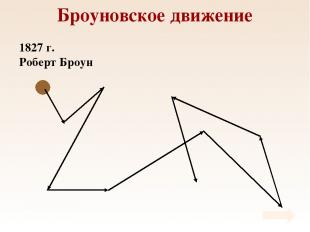
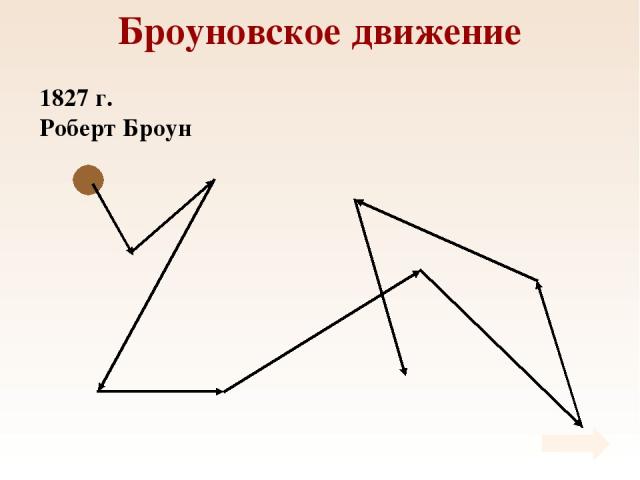
Броуновское движение 1827 г. Роберт Броун

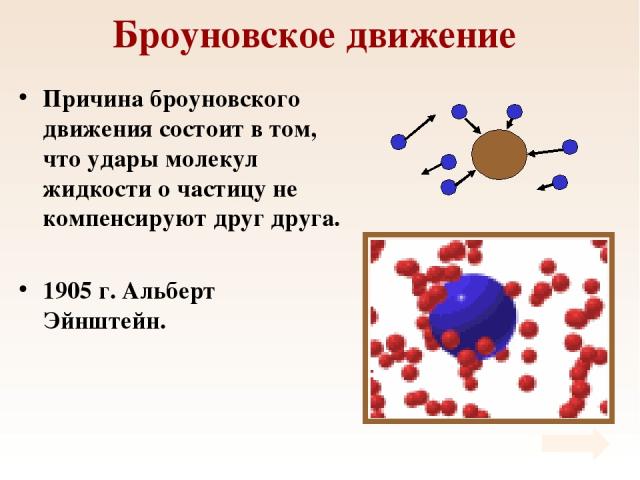
Броуновское движение Причина броуновского движения состоит в том, что удары молекул жидкости о частицу не компенсируют друг друга. 1905 г. Альберт Эйнштейн.

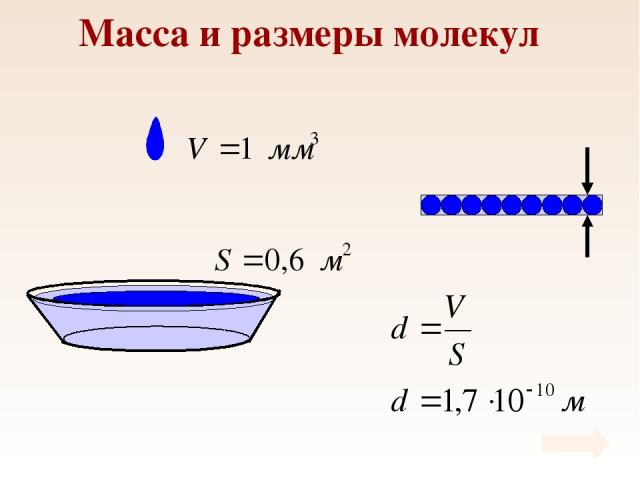
Масса и размеры молекул

Масса и размеры молекул Массы молекул в макроскопических масштабах чрезвычайно малы.
кофе этанол Масса и размеры молекул

Масса и размеры молекул Относительной молекулярной (или атомной) массой вещества (Мr) называют отношение массы молекулы (или атома) m0 данного вещества к 1/12 массы атома углерода m0C. 1961 год

Количество вещества Количество вещества наиболее естественно было бы измерять числом молекул или атомов в теле. Но число частиц в любом макроскопическом теле так велико, что в расчетах используют не абсолютное число частиц, а относительное. Один моль – это количество вещества, в котором содержится столько же молекул или атомов, сколько содержится в углероде массой 12 г.

Количество вещества В 1 моле любого вещества содержится одно и то же число атомов или молекул. Количество вещества равно отношению числа молекул в данном теле к постоянной Авогадро.

Количество вещества Молярной массой вещества называют массу вещества, взятого в количестве 1 моль. m0 - масса одной молекулы или атома

Количество вещества m – масса вещества

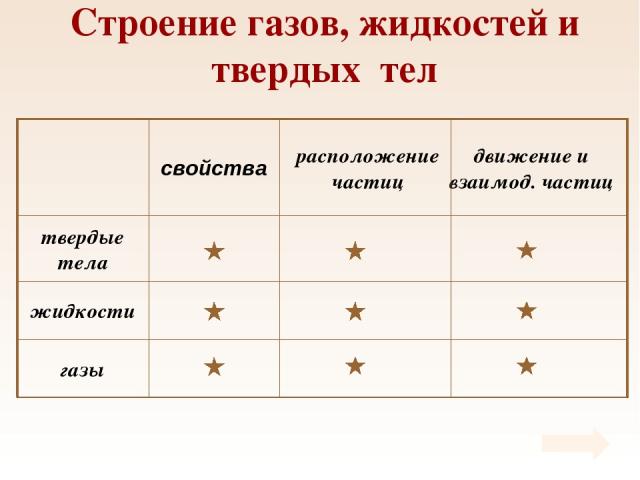
Таблица Свойства газов, жидкостей и твердых тел
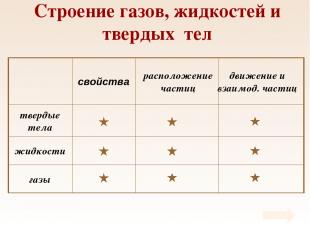
Строение газов, жидкостей и твердых тел

Свойства Твердые тела сохраняют объем и форму.

Свойства Жидкости сохраняют объем и принимают форму сосуда. Обладают текучестью.

Свойства Газы не имеют формы, занимают весь предоставленный объем.

Расположение частиц Частицы расположены в строгом порядке вплотную друг к другу. Кристаллическая решетка.

Расположение частиц Частицы расположены вплотную друг к другу, образуют только ближний порядок.

Расположение частиц Частицы расположены на значительных расстояниях (расстояния между частицами во много раз больше размеров самих частиц).

Движение и взаимодействие частиц Частицы совершают колебательные движения около положения равновесия Силы притяжения и отталкивания значительны

Движение и взаимодействие частиц Частицы совершают колебательные движения около положения равновесия, изредка совершая скачки на новое место Силы притяжения и отталкивания значительны

Движение и взаимодействие частиц Частицы свободно перемещаются по всему объему, двигаясь поступательно Силы притяжения почти отсутствуют, силы отталкивания проявляются при соударениях

Идеальный газ Идеальный газ – это газ, в котором Частицы – материальные точки Частицы взаимодействуют только при соударениях Удары абсолютно упругие

Среднее значение квадрата скорости молекул Скорость – величина векторная, поэтому средняя скорость движения частиц в газе равна нулю.

Среднее значение квадрата скорости молекул
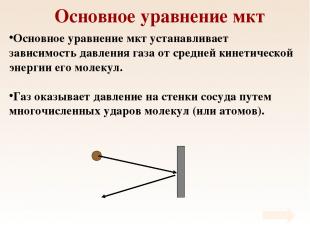
Основное уравнение мкт Основное уравнение мкт устанавливает зависимость давления газа от средней кинетической энергии его молекул. Газ оказывает давление на стенки сосуда путем многочисленных ударов молекул (или атомов).
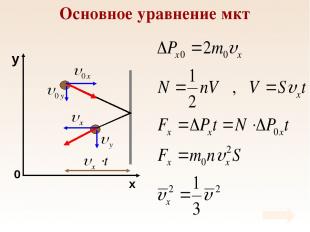
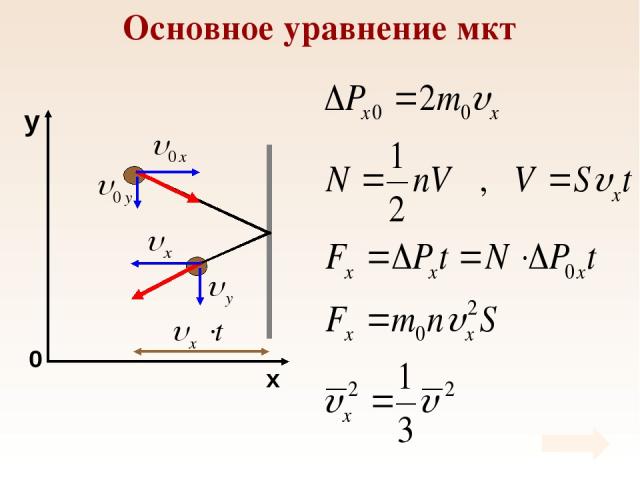
Основное уравнение мкт

Основное уравнение мкт

Температура и тепловое равновесие Макроскопические параметры (макропараметры) – величины, характеризующие состояние макроскопических тел без учета молекулярного строения. (V, p, t ). Тепловым равновесием называют такое состояние, при котором все макроскопические параметры всех тел системы остаются неизменными сколь угодно долго.

Температура и тепловое равновесие Любое макроскопическое тело или группа макроскопических тел при неизменных внешних условиях самопроизвольно переходит в состояние теплового равновесия. Все тела системы, находящиеся друг с другом в тепловом равновесии имеют одну и ту же температуру.

Температура и тепловое равновесие Термометр – прибор для измерения температуры тела. Термометр входит в состояние теплового равновесия с исследуемым телом и показывает свою температуру.

Температура и тепловое равновесие Основная деталь термометра – термометрическое тело, то есть тело, макропараметры которого изменяются при изменении температуры. (Например, в ртутных термометрах термометрическим телом является ртуть – при изменении температуры изменяется ее объем.)

Температура и тепловое равновесие Изобретателем термометра является Галилео Галилей (ок. 1600 г.) Термометрическим телом в его термометре являлся газ – при повышении температуры его объем увеличивался, вытесняя жидкость. Недостатком термометра Галилея являлось отсутствие температурной шкалы.

Температурные шкалы шкала Цельсия шкала Фаренгейта шкала Реомюра шкала Кельвина

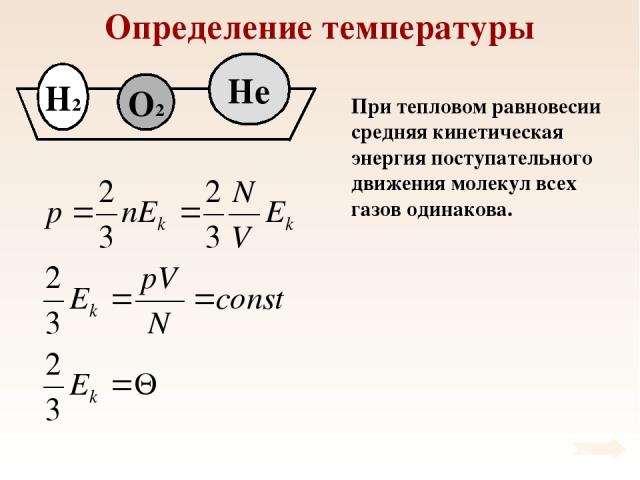
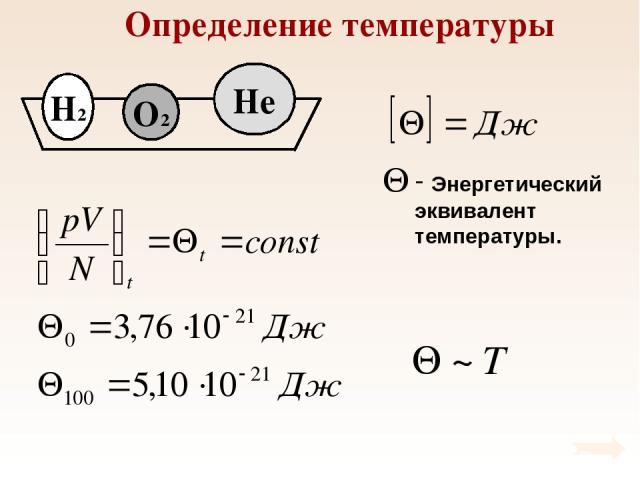
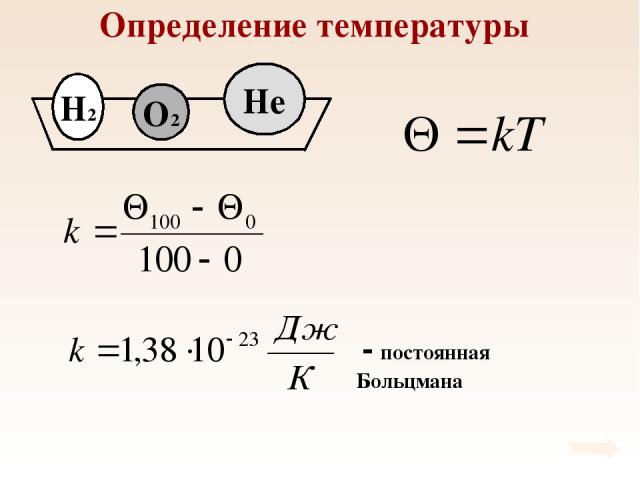
Определение температуры При тепловом равновесии средняя кинетическая энергия поступательного движения молекул всех газов одинакова.
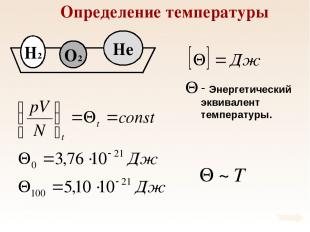
Определение температуры
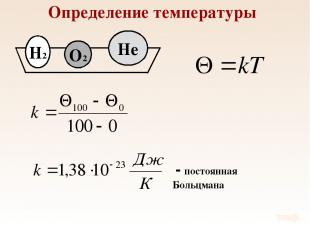
Определение температуры

Температура – мера средней кинетической энергии молекул

Зависимость давления газа от температуры и концентрации молекул газа

Скорости молекул

Уравнение состояния идеального газа (ур-е Менделеева – Клапейрона) - универсальная газовая постоянная

Уравнение состояния идеального газа (ур-е Менделеева – Клапейрона) Если в ходе процесса масса газа остается неизменной, то

Изопроцессы Изотермический процесс Изобарный процесс Изохорный процесс

Изотермический процесс Процесс, происходящий с газом неизменной массы при постоянной температуре называется изотермическим. Изотермический процесс описывается законом Бойля – Мариотта (конец 17 века):

Изобарный процесс Процесс, происходящий с газом неизменной массы при постоянном давлении называется изобарным. Изобарный процесс описывается законом Гей-Люссака (1802 г.):

Изохорный процесс Процесс, происходящий с газом неизменной массы при постоянном объеме называется изохорным. Изохорный процесс описывается законом Шарля (1787 г.):
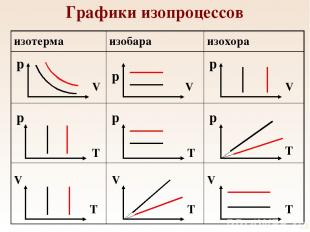
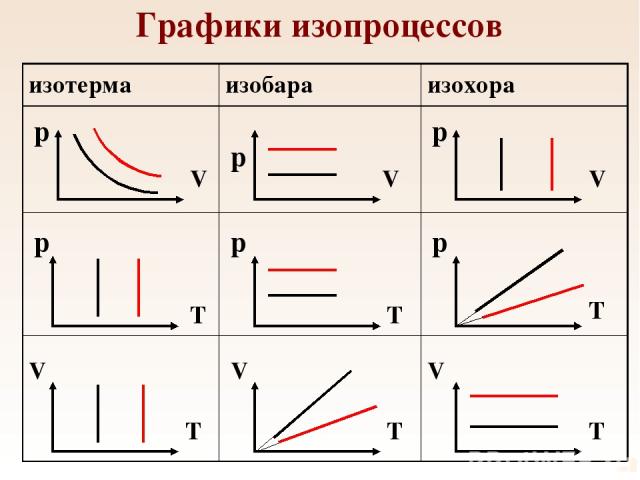
Графики изопроцессов p p p p p p V V V V V V T T T T T T изотерма изобара изохора
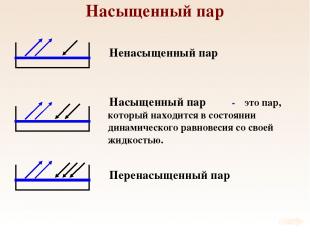
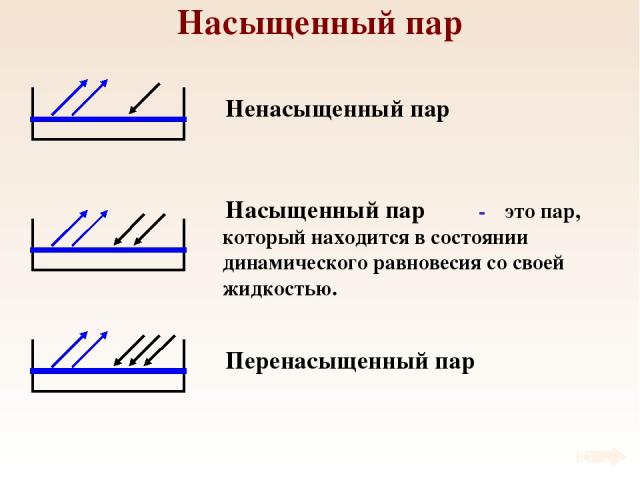
Насыщенный пар Ненасыщенный пар Насыщенный пар Перенасыщенный пар - это пар, который находится в состоянии динамического равновесия со своей жидкостью.
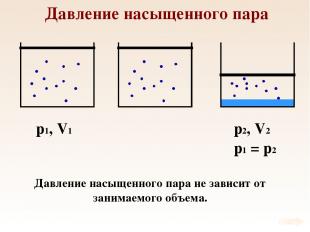
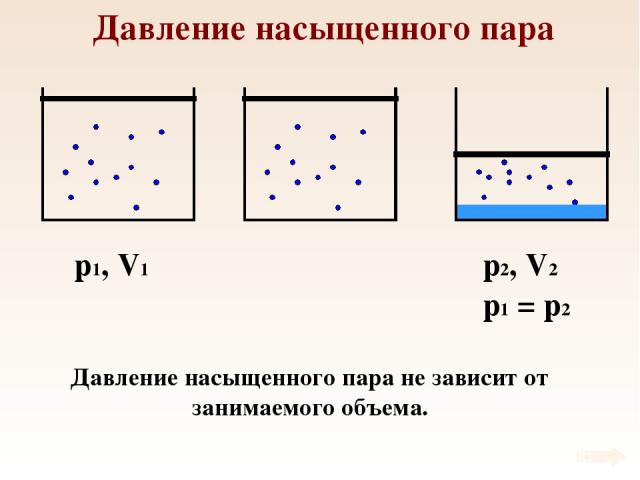
Давление насыщенного пара p1, V1 Давление насыщенного пара не зависит от занимаемого объема.
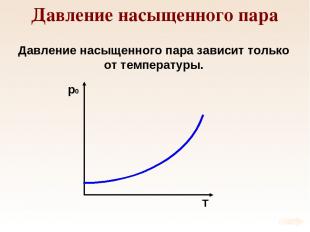
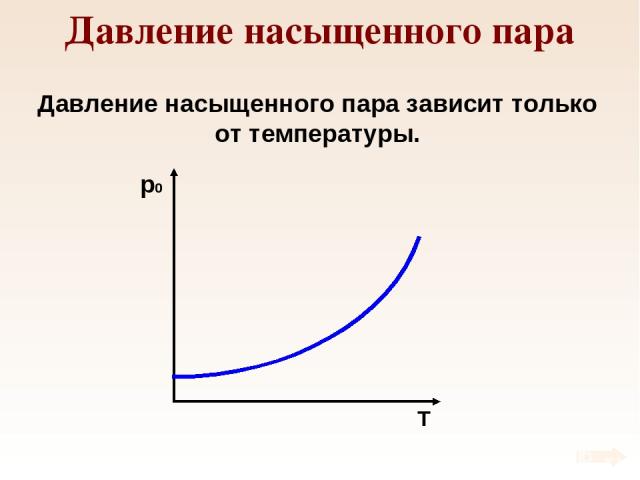
Давление насыщенного пара Давление насыщенного пара зависит только от температуры.
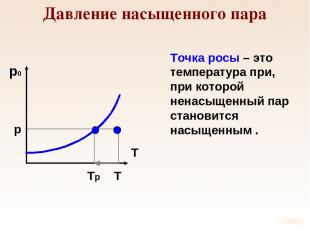
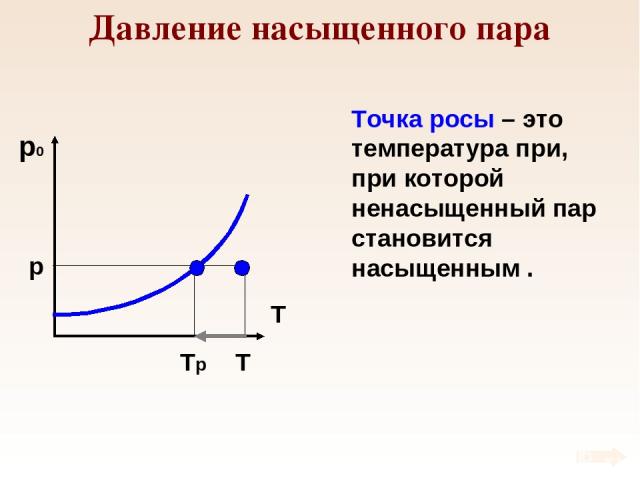
Давление насыщенного пара p T Tр Точка росы – это температура при, при которой ненасыщенный пар становится насыщенным .

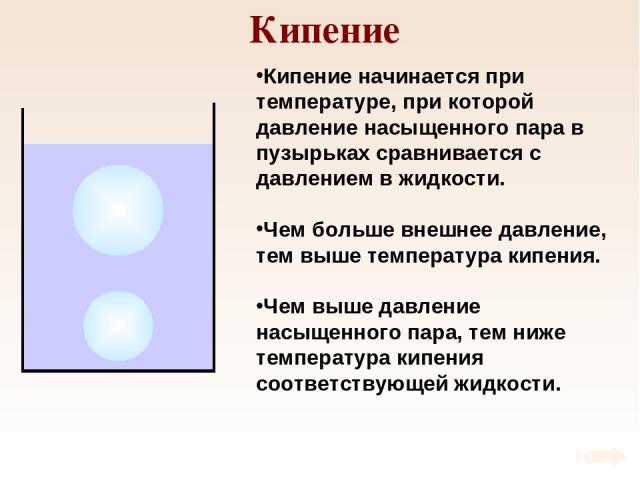
Испарение и кипение Процесс парообразования с поверхности жидкости. Процесс парообразования по всему объему жидкости. Происходит при любой температуре. Происходит при температуре кипения. Скорость испарения зависит от: Вида жидкости Температуры Площади поверхности Наличие ветра Чем ниже давление, тем ниже температура кипения.
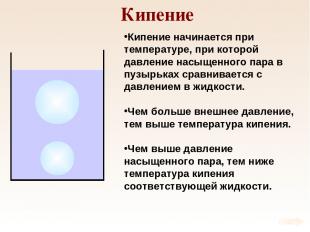
Кипение Кипение начинается при температуре, при которой давление насыщенного пара в пузырьках сравнивается с давлением в жидкости. Чем больше внешнее давление, тем выше температура кипения. Чем выше давление насыщенного пара, тем ниже температура кипения соответствующей жидкости.

Влажность абсолютная относительная Плотность водяных паров в воздухе. Отношение парциального давления водяного пара, содержащегося в воздухе, к давлению насыщенного пара при данной температуре.

Измерение влажности Приборы для измерения влажности: Психрометр Гигрометр
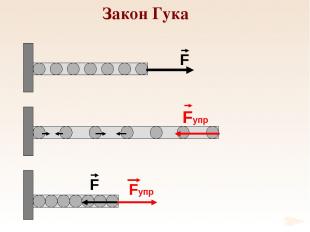
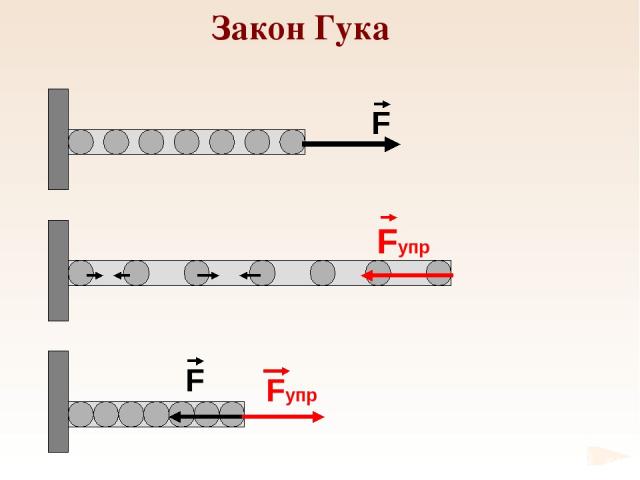
Закон Гука
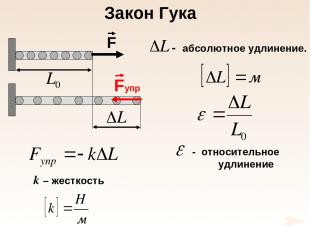
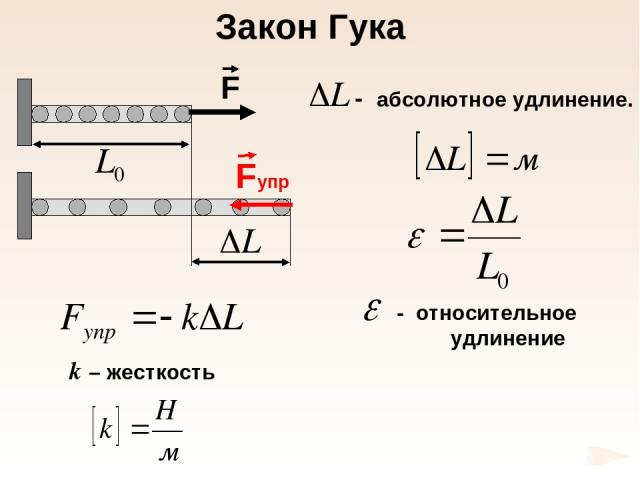
k – жесткость Закон Гука

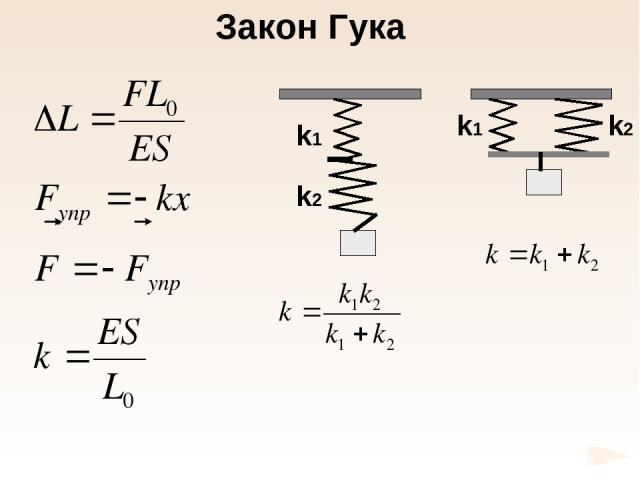
Е – модуль Юнга 1660 г. Закон Гука
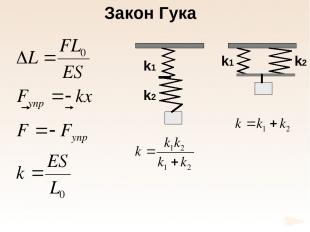
Закон Гука
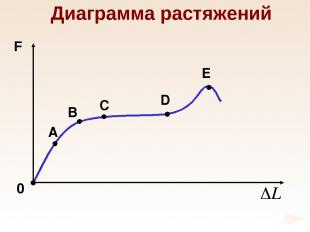
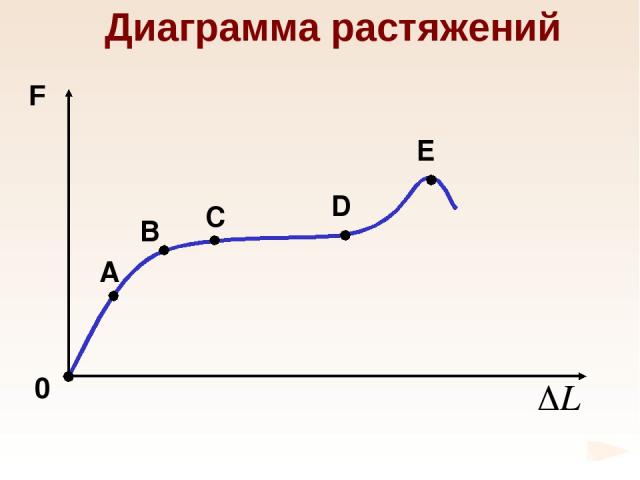
Диаграмма растяжений
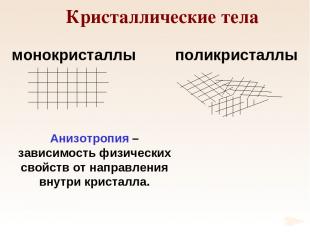
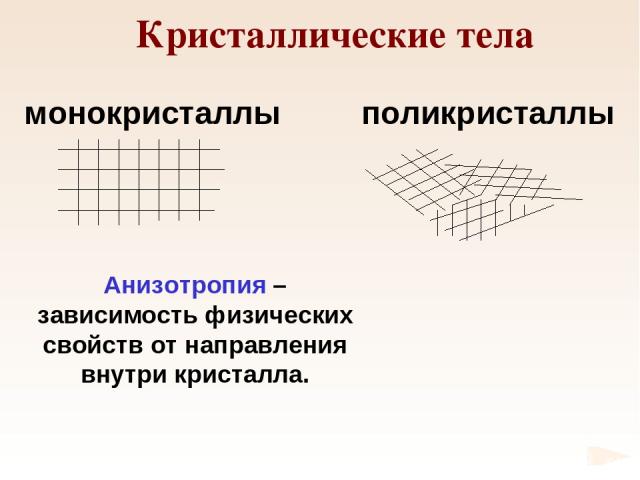
Кристаллические тела монокристаллы поликристаллы Анизотропия – зависимость физических свойств от направления внутри кристалла.

Аморфные тела Нет строгого порядка в расположении атомов. Все аморфные тела изотропны, т.е их физические свойства одинаковы по всем направлениям. Аморфные тела не имеют определенной температуры плавления. При внешних воздействиях аморфные тела обнаруживают одновременно упругие свойства, подобно твердым телам, и текучесть, подобно жидкости.

Внутренняя энергия Внутренняя энергия макроскопического тела равна сумме кинетических энергий беспорядочного движения всех молекул (или атомов) тела и потенциальных энергий взаимодействий всех молекул друг с другом (но не с молекулами других тел).

Внутренняя энергия В идеальном газе частицы не взаимодействуют между собой, следовательно их потенциальные энергии равны нулю.

Внутренняя энергия Одноатомный газ (неон, аргон, гелий) – i = 3. Двухатомный газ (водород, азот) – i = 5. Трехатомный газ (углекислый газ, озон) – i = 6.

Внутренняя энергия Способы изменения внутренней энергии: Передача теплоты Совершение работы
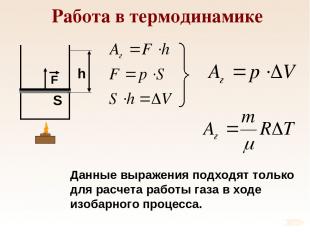
Работа в термодинамике Данные выражения подходят только для расчета работы газа в ходе изобарного процесса.
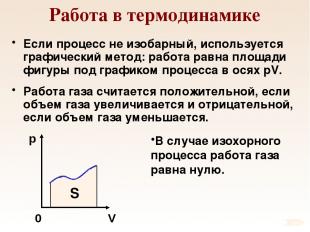
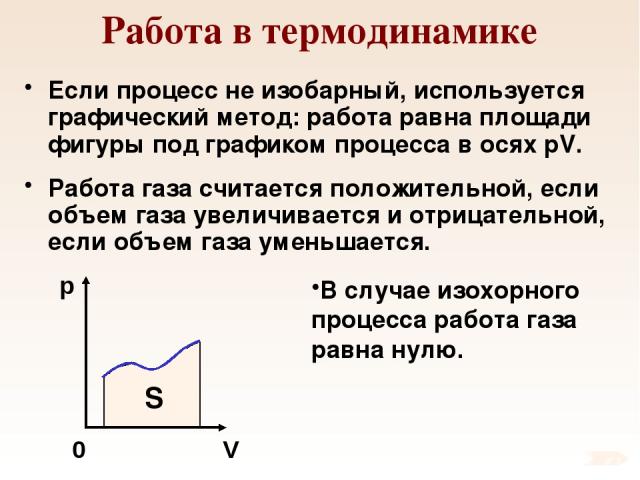
Работа в термодинамике Если процесс не изобарный, используется графический метод: работа равна площади фигуры под графиком процесса в осях pV. Работа газа считается положительной, если объем газа увеличивается и отрицательной, если объем газа уменьшается. В случае изохорного процесса работа газа равна нулю. p

Количество теплоты Количество теплоты – это энергия полученная или отданная телом в процессе теплопередачи. Виды теплопередачи: Теплопроводность Конвекция излучение

Количество теплоты потребляется выделяется нагревание охлаждение с – удельная теплоемкость вещества – величина равная энергии, необходимой для нагревания тела массой 1 кг на 1 К.

Количество теплоты потребляется выделяется плавление кристаллизация

Количество теплоты потребляется выделяется парообразование конденсация L - удельная теплота парообразования вещества – величина равная энергии, необходимой для того, чтобы жидкость массой 1 кг, взятая при температуре кипения полностью перешла в газообразное состояние.

Количество теплоты потребляется выделяется Сгорание топлива q – удельная теплота сгорания топлива – величина равная энергии, которая выделяется при сгорании данного вида топлива массой 1 кг.

Первый закон термодинамики Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе. Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.

Применение первого закона термодинамики к различным процессам Изотермический процесс Изобарный процесс Изохорный процесс Адиабатный процесс

Изотермический процесс В ходе изотермического процесса все полученное системой количество теплоты идет на совершение работы.

Изобарный процесс Данный способ расчета внутренней энергии и количества теплоты подходит только для одноатомного газа.

Изобарный процесс Если газ не одноатомный, то Можно воспользоваться следующими выражениями: i – число степеней свободы движения частиц.

Изохорный процесс В ходе изохорного процесса все полученное системой количество теплоты идет на изменение внутренней энергии системы.

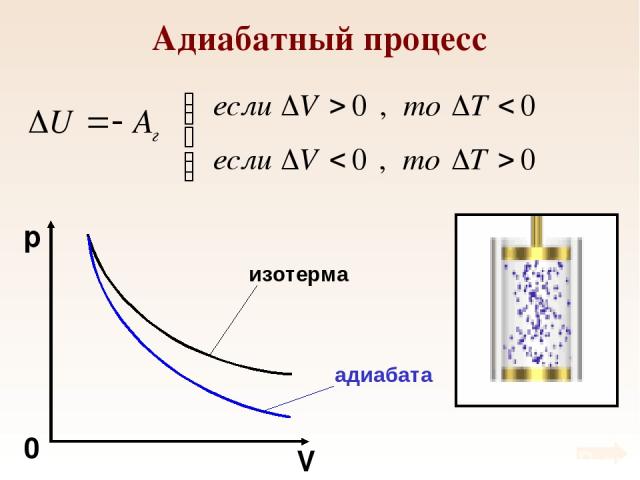
Адиабатный процесс Процесс, который происходит без теплообмена с внешней средой называется адиабатным. В ходе адиабатного процесса газ совершает работу за счет изменения внутренней энергии.
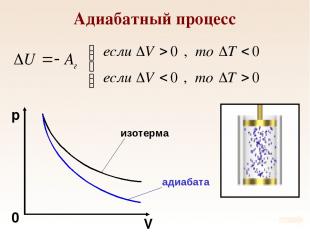
Адиабатный процесс

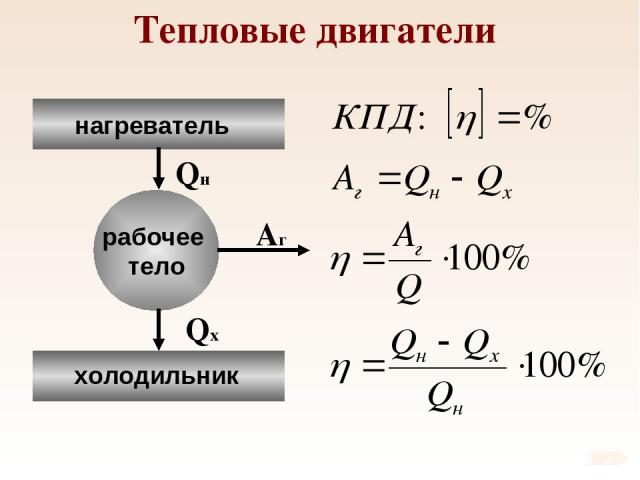
Тепловые двигатели Тепловые двигатели – механизмы, преобразующие внутреннюю энергию топлива в механическую энергию. Основные детали: нагреватель, холодильник и рабочее тело. В качестве рабочего тела в т.д. выступает газ.

Тепловые двигатели
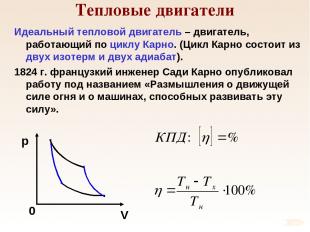
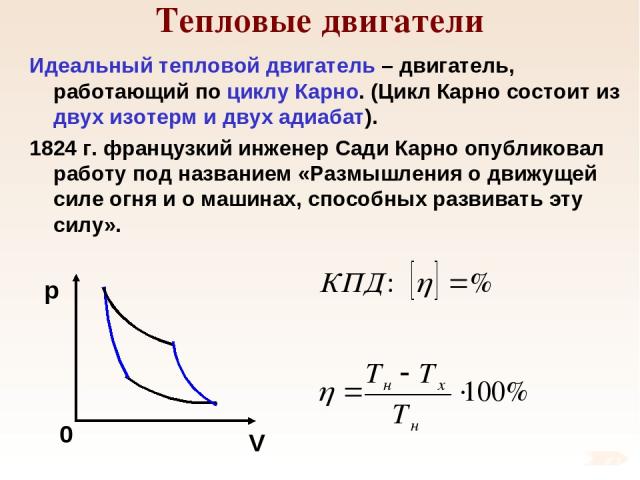
Тепловые двигатели Идеальный тепловой двигатель – двигатель, работающий по циклу Карно. (Цикл Карно состоит из двух изотерм и двух адиабат). 1824 г. французкий инженер Сади Карно опубликовал работу под названием «Размышления о движущей силе огня и о машинах, способных развивать эту силу».