Презентация на тему: Газовые законы


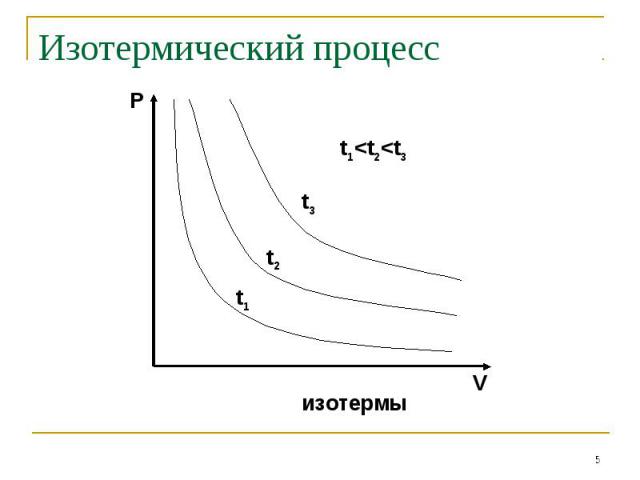
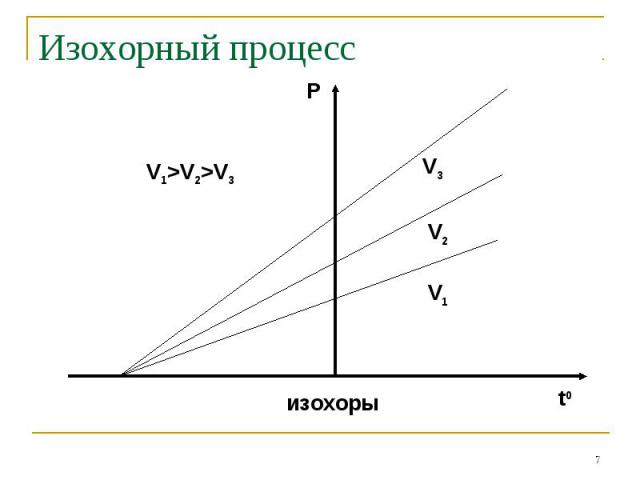
Закон Бойля-Мариотта: P V=const при t0=const Закон Бойля-Мариотта: P V=const при t0=const Закон Шарля: P/T=const при V=const Закон Гей-Люссака: V/T=const при P=const Закон Авогадро: одинаковые количества газов при одинаковых температуре и давлении занимают одинаковый объём

Законы Шарля и Гей-Люссака имеют такой простой вид если температура измеряется по абсолютной шкале Законы Шарля и Гей-Люссака имеют такой простой вид если температура измеряется по абсолютной шкале Первоначально эти законы были сформулированы для температуры, измеренной в некоторой практической шкале. В этом случае они имеют более сложный вид: P=P0[1+ (t-t0)] V=V0[1+ (t-t0)] при чём коэффициенты и оказались равными и не зависящими от рода газа

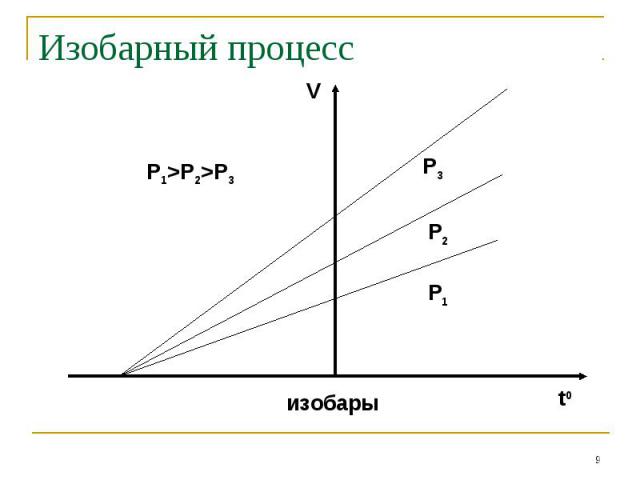
Процессы, описываемые уравнениями 1-3 называются изопроцессами: Изотермическим Изохорным Изобарным
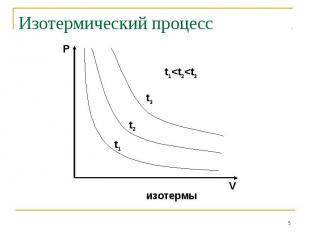
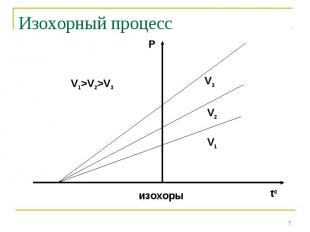
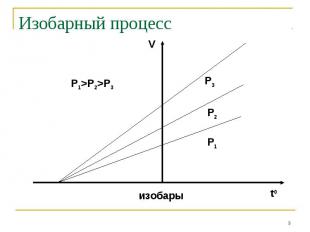

Если измерять температуру по шкале Цельсия, то оказывается, что точка пересечения изохорного и изобарного процессов с осью температур имеет координату t=-373,15 0С. Это значит, что = =1/273,15 1/0С

Если ввести новую шкалу температур, такую, что Т=t+273,15, то уравнения примут более простой вид: Если ввести новую шкалу температур, такую, что Т=t+273,15, то уравнения примут более простой вид: P/T=const V/T=const Определённая таким образом температура называется абсолютной температурой
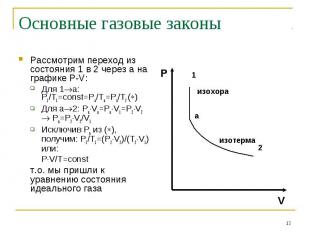
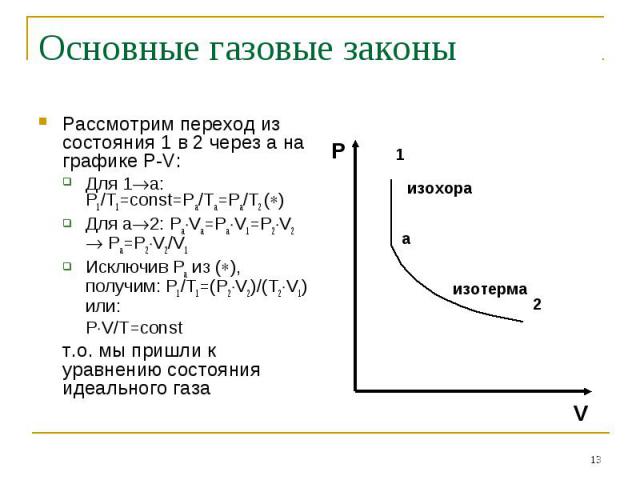
Рассмотрим переход из состояния 1 в 2 через а на графике P-V: Рассмотрим переход из состояния 1 в 2 через а на графике P-V: Для 1 а: P1/T1=const=Pa/Ta=Pa/T2 ( ) Для а 2: Pa Va=Pa V1=P2 V2 Pa=P2 V2/V1 Исключив Ра из ( ), получим: P1/T1=(P2 V2)/(T2 V1) или: P V/T=const т.о. мы пришли к уравнению состояния идеального газа

Из закона Авогадро следует, что величина соотношения (P V)/T не зависит от вида газа, значит мы можем записать, что для одного моля любого газа (P V)/T=R, где R – универсальная газовая постоянная, называемая постоянной Авогадро Из закона Авогадро следует, что величина соотношения (P V)/T не зависит от вида газа, значит мы можем записать, что для одного моля любого газа (P V)/T=R, где R – универсальная газовая постоянная, называемая постоянной Авогадро R=8,31 Дж/(град моль) Из закона Дальтона следует, что при постоянных V и Т, Р является линейной функцией количества вещества

Т.о., мы пришли к уравнению Клапейрона-Менделеева: P V= R T или P V=(m/ ) R T