Презентация на тему: Газовые законы


Идеальный газ Исторические данные Закон Бойля – Мариотта Закон Шарля Закон Гей – Люссака Сводная таблица Разбор задачи на построение Задачи для самостоятельного решения Домашнее задание

Газовые законы рассматриваются для идеального газа. Модель идеального газа предполагает следующее: молекулы обладают пренебрежимо малым объемом по сравнению с объемом сосуда, между молекулами не действуют силы притяжения, при соударении молекул друг с другом и со стенками сосуда действуют силы отталкивания.

Состояние идеального газа характеризуется тремя макроскопическими параметрами: P – давление (Па) T – температура (ºС) V – объем (м²)

Уравнение состояния идеального газа

Бенау Клайперон (1799-1864) французский физик получил зависимость, уравнение устанавливающее связь между: P,T, V


Уравнение Менделеева – Клапейрона:

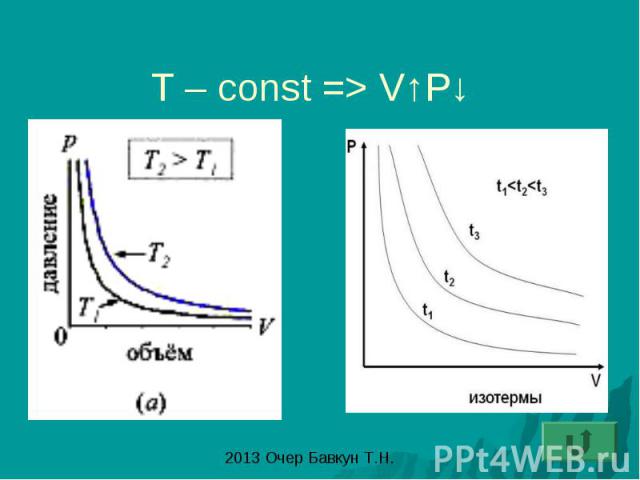
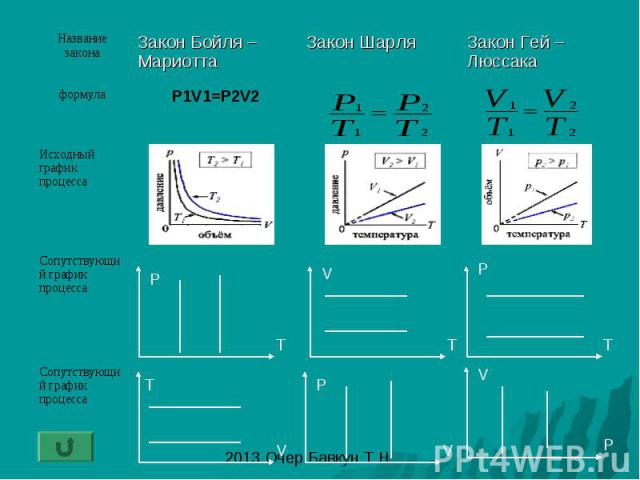
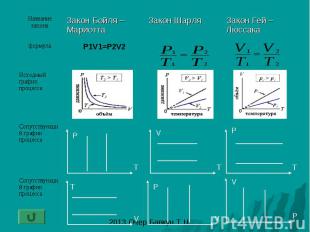
Закон Бойля – Мариотта: изотермический процесс- процесс изменения состояния газа при постоянной температуре (T-const)
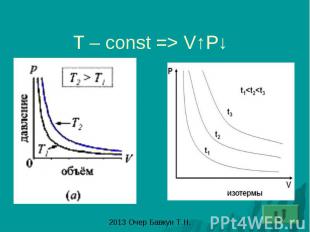
T – const => V↑P↓

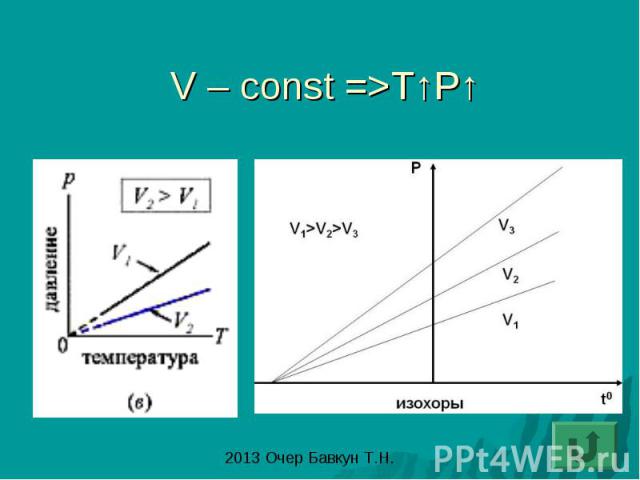
Закон Шарля: изохорный процесс- процесс изменения состояния газа при постоянном объеме (V-const)
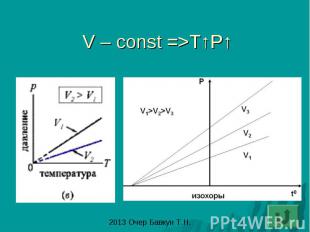
V – const =>T↑P↑

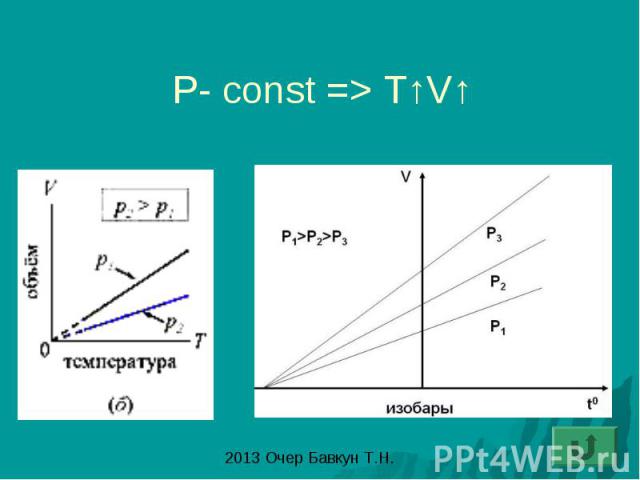
Закон Гей – Люссака: изобарный процесс - процесс изменения состояния газа при постоянном давлении (P-const)
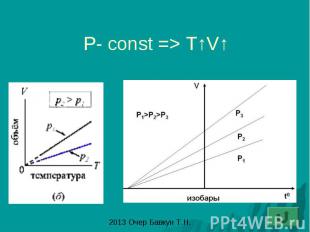
P- const => T↑V↑
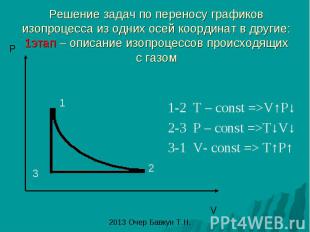
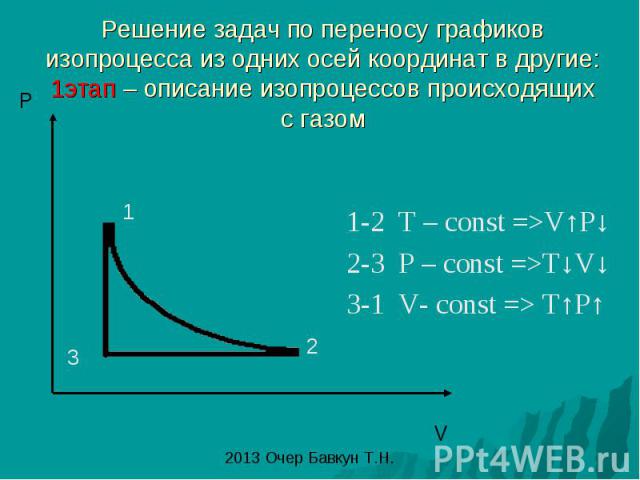
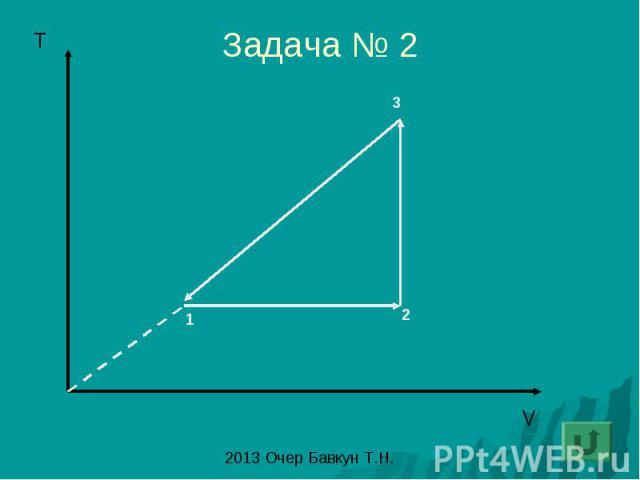
Решение задач по переносу графиков изопроцесса из одних осей координат в другие: 1этап – описание изопроцессов происходящих с газом 1-2 T – const =>V↑P↓ 2-3 P – const =>T↓V↓ 3-1 V- const => T↑P↑
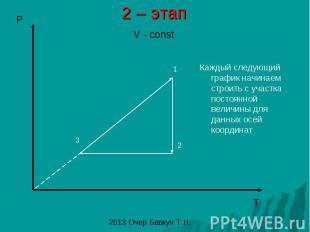
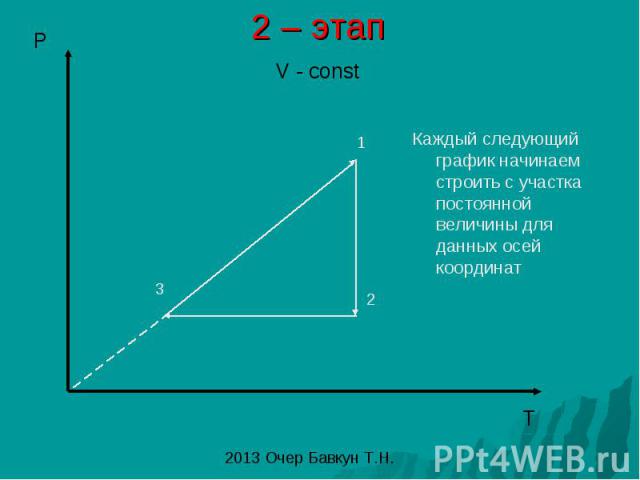
2 – этап Каждый следующий график начинаем строить с участка постоянной величины для данных осей координат
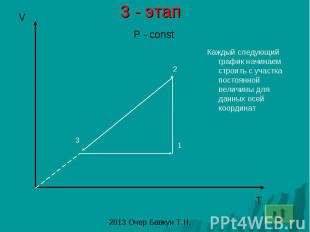
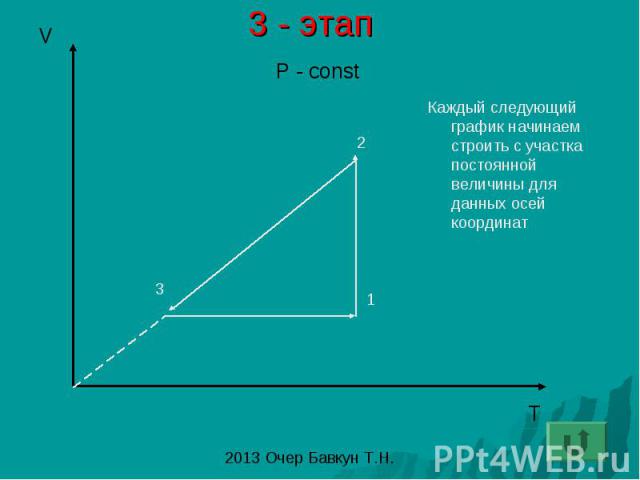
3 - этап Каждый следующий график начинаем строить с участка постоянной величины для данных осей координат
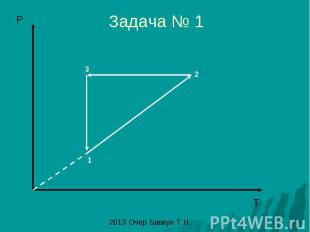
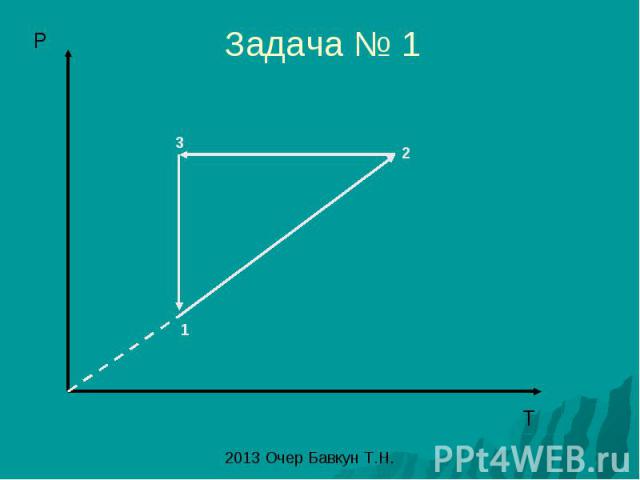
Задача № 1
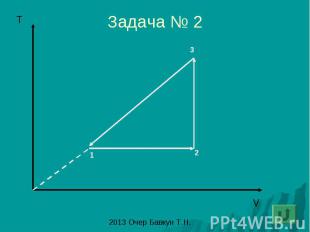
Задача № 2
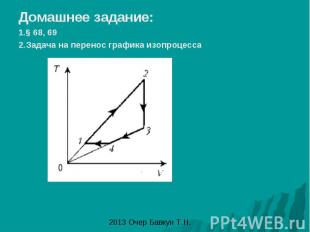
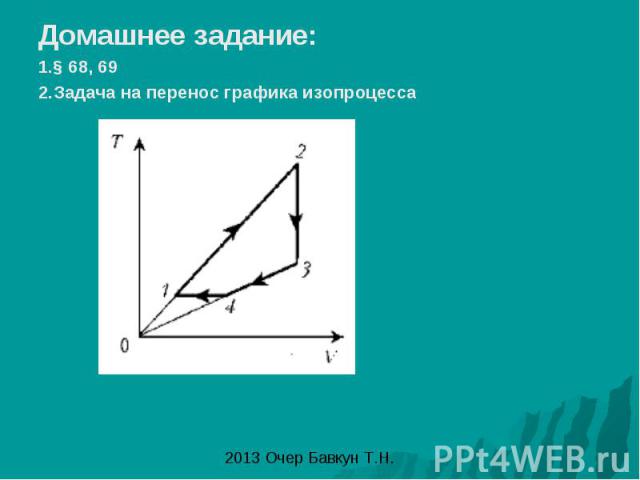
Домашнее задание: 1.§ 68, 69 2.Задача на перенос графика изопроцесса