Презентация на тему: Актуальные вопросы регулирования обращения биологических препаратов

Актуальные вопросы регулирования обращения биологических препаратов Ростова Наталья Борисовна Доцент, канд.фарм. наукАпрель, Москва, 2010 г.

Основные проблемы Перспективы рынка биологических ЛСБиологическое ЛС, биоаналог – определения и отличия Свойства и особенности ЛС биологической природыОсобенности регулирования обращенияВзаимозаменяемостьВыводы

Биофармацевтический рынок является привлекательным для фармацевтических компаний Объем мировых продаж биофармацевтического рынка за период 2003-2005г. увеличился с 52,6 до 70,8 млрд. долл., т.е. на 34%1Положительная динамика рынка делает его привлекательным для многих фармацевтических компаний1

Препараты биологической природы Первые биологические лекарственные средства начали использоваться в клинической медицине в 80-х гг.Более 150 препаратов в миреБолее 370 препаратов в процессе разработки для терапии различных серьезных медицинских показаний

Биологические препараты Группа ЛС, близких по строению/ составу к природным веществам, синтезируемым в организме человека/ животных/ микроорганизмов. любые сыворотки, белки, вакцины, вирусы, компоненты крови и препараты, выделенные из крови. В состав биопрепаратов могут входить сахара, белки, нуклеиновые кислоты или сложные комбинации этих веществМогут представлять собой биологические объекты – например, клетки и ткани.Энциклопедический словарь терминов фармакологии, фармакотерапии и фармации под ред. Г.Я. Шварца

Биологическое лекарственное средство иммунобиологические лекарственные средства; лекарственные средства, производимые путем биотехнологических процессов: технология рекомбинантной ДНК; контролируемая экспрессия генов, кодирующих выработку биологически активных белков,методы с использованием гибридом и моноклональных антителгенотерапевтические и соматотерапевтические лекарственные средства

Биологические препараты Потенциал медицинского применения клеточных и генных биологических препаратов лечение многих заболеваний, неизлечимых в настоящий момент.Примеры:Инсулины;Соматотропный гормон;Интерфероны;Иммуноглобулины;Эритропоэтины;Циклоспорины;Факторы свертывания крови;Колониестимулирующий фактор;Вакцины

Определение понятия «биологическое ЛС»

Чем отличаются биопрепараты от других ЛС? Высоким молекулярным весомСложностью пространственной структуры:Четвертичная структураОпределенное соотношение изоформСтепень гликозилированияСледующими характеристиками:Длительной и наукоемкой технологией производстваВысокой степенью биофармацевтической очисткиВысокой чувствительностью к влиянию на стабильность различных факторов:Лекарственная формаТранспортировкаУсловия храненияИммуногенностью
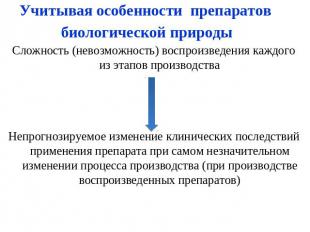
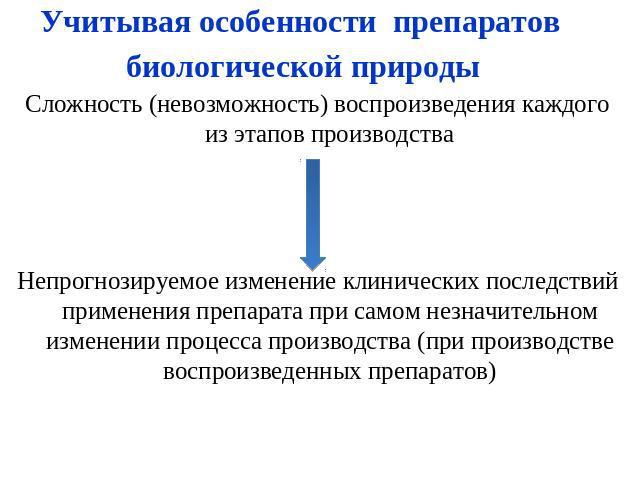
Учитывая особенности препаратов биологической природы Сложность (невозможность) воспроизведения каждого из этапов производстваНепрогнозируемое изменение клинических последствий применения препарата при самом незначительном изменении процесса производства (при производстве воспроизведенных препаратов)

Воспроизведенные препараты биологической природы (биоаналоги)Недостаток средств на лекарственное обеспечение стимулирует использование воспроизведенных препаратов во всем мире в силу экономических причинСоответствуют ли биоаналоги по показателям эффективности и безопасности оригинальным препаратам?

Почему надо с особенной осторожностью говорить о равнозначности (взаимозаменяемости) биологических лекарственных средств? Биоаналог = дженерик? «Биоаналог - это биологическое лекарственное средство, схожее с оригинальным биологическим лекарственным средством, но не являющийся его дженериком в связи с различиями в исходном сырье и производстве оригинального биологического лекарственного средства и биоаналога,…»

Какова законодательная основа регуляции обращения воспроизведенных лекарственных средств в РФ?

Утвержден Приказом МинистерстваЗдравоохранения и социального развития РФ от 30.10.06. №736 АДМИНИСТРАТИВНЫЙ РЕГЛАМЕНТФЕДЕРАЛЬНОЙ СЛУЖБЫ ПО НАДЗОРУВ СФЕРЕ ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯПО ИСПОЛНЕНИЮ ГОСУДАРСТВЕННОЙ ФУНКЦИИ ПОГОСУДАРСТВЕННОЙ РЕГИСТРАЦИИЛЕКАРСТВЕННЫХ СРЕДСТВ

АДМИНИСТРАТИВНЫЙ РЕГЛАМЕНТ от 30.10.06. №736 «…В том случае, если отличия регистрируемого ЛС от ранее зарегистрированного относятся только к составу вспомогательных веществ и технологии производства и такие отличия не могут оказывать влияние на качество, эффективность и безопасность ЛС, должна быть применена процедура ускоренного рассмотрения документов и принятия решения о государственной регистрации…»

АДМИНИСТРАТИВНЫЙ РЕГЛАМЕНТ от 30.10.06. №736 Для прохождения ускоренной процедуры рассмотрения документов и принятия решения о государственной регистрации, документы и данные указанные в подпунктах 11-13 пункта 3.3.3. настоящего Регламента могут быть представлены в виде ссылок на открытые литературные источники и в виде отчета об исследованиях биоэквивалентности, проведенных с учетом требований Приложения 1 к таким данным…….»

АДМИНИСТРАТИВНЫЙ РЕГЛАМЕНТ (продолжение) 1) заявление о государственной регистрации ЛС; 2) квитанцию об осуществлении платы за государственную регистрацию ЛС;3) юридический адрес организации - производителя ЛС;4) названия ЛС, включая МНН, научное название на латинском языке, основные синонимы;5) оригинальное название ЛС, если оно зарегистрировано как торговый знак в соответствии с законодательством Российской Федерации о торговых знаках, знаках обслуживания и наименованиях мест происхождения товаров;6) перечень компонентов, входящих в состав ЛС, их количество;7) инструкцию по применению ЛС, оформленную в соответствии с требованиями статьи 16 Федерального закона от 22.06.98 N 86-ФЗ "О лекарственных средствах";8) сертификат качества ЛС;9) данные о производстве ЛС, первоначальный текст фармакопейной статьи (нормативного документа);10) методы контроля качества ЛС;11) результаты доклинических исследований ЛС;12) результаты фармакологических и токсикологических исследований ЛС;13) результаты клинических исследований ЛС;14) образцы ЛС для проведения экспертизы его качества;15) предложения по цене ЛС;16) документы, подтверждающие регистрацию ЛС, если оно зарегистрировано вне пределов РФ.

Терапевтическая эквивалентность Лекарственный препарат терапевтически эквивалентен другому препарату, если он содержит ту же активную субстанцию или лекарственное вещество и, по результатам клинических исследований, обладает такой же эффективностью и безопасностью, как и препарат сравнения, чья эффективность и безопасность установлены {EU}. Терапевтически эквивалентными лекарственные препараты могут считаться только в том случае, если они фармацевтически эквивалентны и можно ожидать, что они будут иметь одинаковый клинический эффект и одинаковый профиль безопасности при использовании пациентами в соответствии с указаниями на этикетке {FDA}.

Подтверждение терапевтической эквивалентности: доказательство биоэквивалентности; сравнительное определение фармакодинамических характеристик; сравнительные клинические испытания; определение растворимости дозированной формы.Подтверждение биоэквивалентности ещё не свидетельствует о терапевтической эквивалентности сравниваемых препаратов.The rules governing medicinal products in the European Union.Investigation of Bioavailability and Bioequivalence.1998, v. 3C, pp.231-244

Примеры отзывов биоаналогов с рынка 1996 г, рекомбинантный человеческий интерферон альфа (Lemery, Куба). 1997 г, эпоэтин альфа (Cryopharma)1998 г, интерферон альфа (Fustery)Причина – большое количество побочных реакций, т.к. безопасность препарата не была изучена на момент регистрации

Учитывая вышесказанные аспекты в европейском и американском законодательстве предусмотрены особые требования по регистрации воспроизведенных ЛС биологической природы и их замены при назначении

Регистрация биоаналогов Регуляторные органы в ЕС (ЕМЕА) и США (FDA) признают, что биоаналоги отличаются от генериковых препаратов, а именно по: размеру и сложности активной субстанцииГетерогенности продуктаБезопасности и эффективности, зависящим от исходного материала и процесса производстваНевозможности полностью определить структуру молекулы современными аналитическими методами, что может повлиять на эффективность и безопасностьИммунной реакции организма (иммуногенность)Принципы регистрации генериковых препаратов не могут быть применимы к биоаналогам

Регистрация биоаналогов в ес Появление Директив, описывающих регистрацию биоаналогов в ЕС:Directive 2003/63/EC of 25 June 2003 (Annex I): deadline for national implementation 1 July 2003 Directive 2004/27/EC of 31 March 2004 (amending Directive 2001/83/EC): deadline for national implementation 30 October 2005Regulation 726/2004 of 31 March 2004: came into force as of 20 November 2005Четко прописаны определения, требования и процесс регистрации для биоаналогов

Законодательная основа для биоаналогов Directive 2004/27/EC – Article 10.4 (Определение):«В случае если биологический препарат аналогичный оригинальному биологическому препарату не подпадает под определение генерического препарата, особенно при наличие отличий в исходных материалах и процессе производства, необходимо предоставить результаты доклинических тестов и клинических испытаний при его регистрации». Биоаналог Генерик

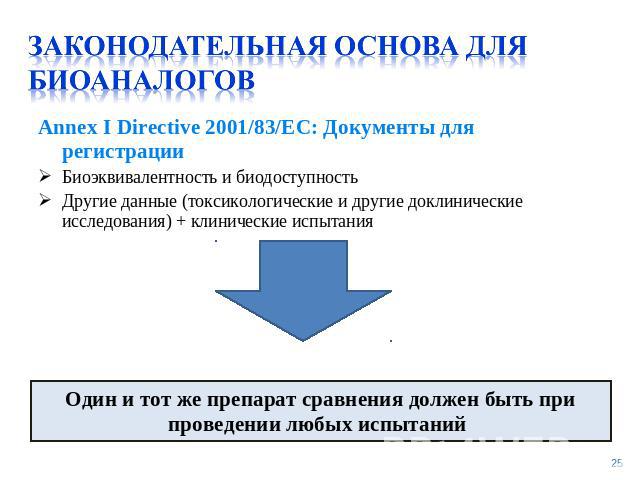
Законодательная основа для биоаналогов Annex I Directive 2001/83/EC: Документы для регистрации Биоэквивалентность и биодоступностьДругие данные (токсикологические и другие доклинические исследования) + клинические испытанияОдин и тот же препарат сравнения должен быть при проведении любых испытаний

Основные аспекты новых требований в ес Процедура центральной регистрации (Centralized procedure) для всех биопрепаратов и их аналоговЖесткие требования при оценке документов, поданных на регистрацию с точки зрения эффективности, безопасности и качества Препарат сравнения должен иметь регистрацию в ЕСИндивидуальный подход при регистрации каждого биоаналога
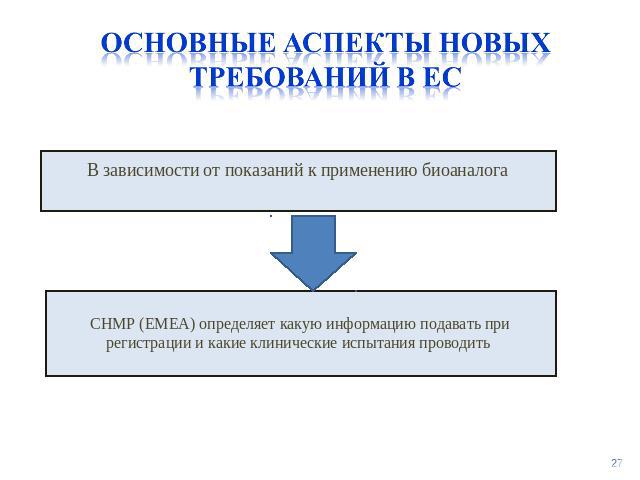
Основные аспекты новых требований в ес В зависимости от показаний к применению биоаналогаCHMP (EMEA) определяет какую информацию подавать при регистрации и какие клинические испытания проводить

EMEA не гарантирует взаимозаменяемость биологических лекарственных препаратов EMEA не гарантирует взаимозаменяемость биологических лекарственных средств и аналогов, в отличие от традиционных дженериков (“the decision … outside the organization's remit”- EMEA Executive Director Thomas Lonngren) Органы здравоохранения должны решать вопрос взаимозаменяемости

Обзор взаимозаменяемости биологических лекарственных средств в различных странах
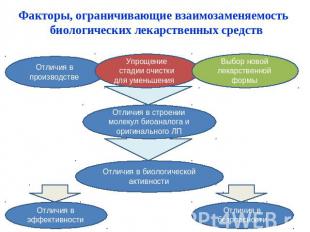
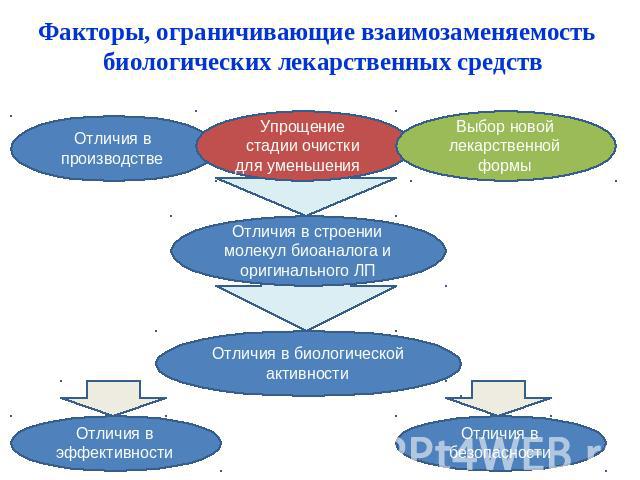
Факторы, ограничивающие взаимозаменяемость биологических лекарственных средств

Регулирование взаимозаменяемости биологических лекарственных средств в Российском законодательстве При отпуске препарата по рецепту врача разрешается отпуск любого препарата в рамках одного МННПроведение закупок препаратов в рамках государственных программ по МНН не учитывает особенности действия различных групп лекарственных препаратов и делает возможным выбор препарата по единственному показателю - ценаПервый шаг по регулированию взаимозаменяемости на российском рынке – разрешение закупок инсулинов и циклоспорина по торговым наименованиям

Некоторые аспекты законодательства в области обращения биологических лекарственных средств

Выводы: Гармонизация российского законодательства в области обращения биологических ЛС с законодательством стран Европы Внесение определения «биологические ЛС» и «воспроизведенные биологические ЛС» в действующее законодательство.Регламентация регистрации воспроизведенных биологических ЛС, с учетом требований к предоставлению данных сравнительных клинических исследований биоаналога и оригинального препарата. Регламентация порядка замены оригинального биологического ЛС на воспроизведенное в аптечном учреждении только по согласованию с врачом.Разработка списка невзаимозаменяемых лекарственных препаратов. Получение одобрения на составление заявок на закупку биологических ЛС по торговому наименованию

Существующие аспекты регулирования обращения препаратов биологической природы в РФ не гарантируют качества, эффективности безопасности оказываемой лекарственной терапии при выборе биоаналога для организации лекарственного обеспечения