Презентация на тему: Железо и его соединения

Железо и его соединения

Проверить знание основных теоретических вопросов темы “Железо и его соединения”;Развивать умения составлять электронный баланс и уравнения, соответствующие цепочке превращений;Закрепить теоретические знания практическим путем. Провести контроль усвоения основных теоретических понятий.

Происхождение названия Ferrum от латинского fers - быть твердым, что в свою очередь происходит от санскритского «меч».

Вопросы по теме «Железо и его соединения» Напишите электронно-графическую формулу атома железа. Укажите валентные электроны. Какие степени окисления проявляет железо? Какие оксиды и гидроксиды соответствуют этим степеням окисления?В каком состоянии железо встречается в природе? Назовитеважнейшие природные соединения железа.Каковы физические свойства железа?С какими простыми веществами реагирует железо? Напишитеуравнения реакций и назовите полученные вещества. Что такое ржавчина и как она образуется? (подготовьтесь у доски)С какими сложными веществами реагирует железо? Напишите уравнения реакций и назовите их продукты. (подготовьтесь у доски)

Вопросы по теме «Железо и его соединения» Какие гидроксиды образует железо? Укажите их кислотно-основный характер. Напишите уравнения реакций, характерных для гидроксидов железа (+2) и (+3).Почему гидроксид железа (II) со временем становится бурым?Какие вы знаете качественные реакции на ионы железа +2 и +3?.Биологическая роль железа и его соединений.

Качественные реакции на Fe 2+ FeCl2+2NaOHFe(OH)2 + 2NaCl зеленый2. FeCl2 + K3(Fe(CN)6) красная кровяная соль KFe(Fe(CN)6) + 2KCl «турнбуллева синь»

Качественные реакции на Fe 3+ FeCl3+3NaOHFe(OH)3 + 3NaCl бурый2. FeCl3 + K4(Fe(CN)6) желтая кровяная соль KFe(Fe(CN)6) + 3KCl «берлинская лазурь»

Качественные реакции на Fe 3+ 3. FeCl3 + KCNS Fe(CNS)3 +3KCl роданид калия

“Порядок ли у вас с железом”. 1. Часто ли вы чувствуете усталость и подавленность?2. Произошли ли у вас в последнее время изменения кожи, волос и ногтей?3. Теряли ли вы в последнее время много крови?4. Занимаетесь ли вы профессиональным спортом?5. Вы редко или совсем не едите мясо?6. Выпиваете ли вы более трех чашек чая или кофе в день?7. Вы едите мало овощей?

Основные источники железа: Зеленные овощи;Яичный желток;Печень;Горошек зеленый;Томаты сырые;Капуста;Чеснок;Яблоки, груши;Земляника;Сухофрукты.
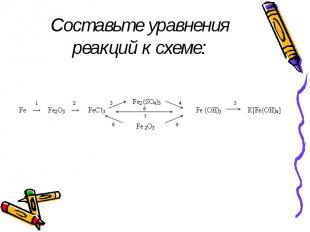
Составьте уравнения реакций к схеме:

Составьте электронный баланс: 1. FeCl3 + H2S FeCl2 + S +HCl2. FeSO4 + K2Cr2O7 + H2SO4 Fe2(SO4)3 +Cr2(SO4)3 +K2SO4+H20

Проверьте себя!

Домашнее задание:§83-84, читать;Записи в словаре выучить;Задание №2 страница 292 (письменно)

Спасибо за урок!