Презентация на тему: презентация железо и его соединения 9 класс

Железо и его соединения (презентация к уроку, 9 класс) Автор:Скорочкина Ольга Александровна, учитель химии МОУ « СОШ с. Малый Узень» Муниципальное общеобразовательное учреждение средняя общеобразовательная школа с. Малый Узень Питерского района Саратовской области

Загадка Очень древний я металл, Счёт столетьям потерял. Был нескромным я не в меру, Тысячи лет до нашей эры. А за блеск, мерцавший холодом, Люди там платили золотом! Я давно в названии века, В организме человека. Называют мной характер, Из меня почти весь трактор. Очень в яблоке полезно, И зовут меня …

«Третий лишний». Задание: Решите анаграммы и исключите лишнее. леруогд иксолодр ддрооов золеже углерод кислород водород железо

Охарактеризуйте Fe как химический элемент, составив предложения со словами и словосочетаниями: Порядковый номер, номер периода , группа, подгруппа Порядковый № 26, 4 период , VIII В группа Заряд ядра, распределение электронов по уровням Заряд ядра +26, распределение é 2, 8, 14, 2 Запомни! Особенностью электронного строения элементов побочных подгрупп является заполнение электронами не последнего, а предпоследнего уровня.

Задание Закончите электронно - буквенную формулу и нарисуйте графическую формулу строения атома железа: Железо(№ 131835)
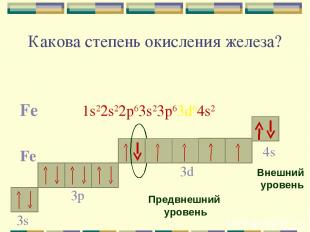
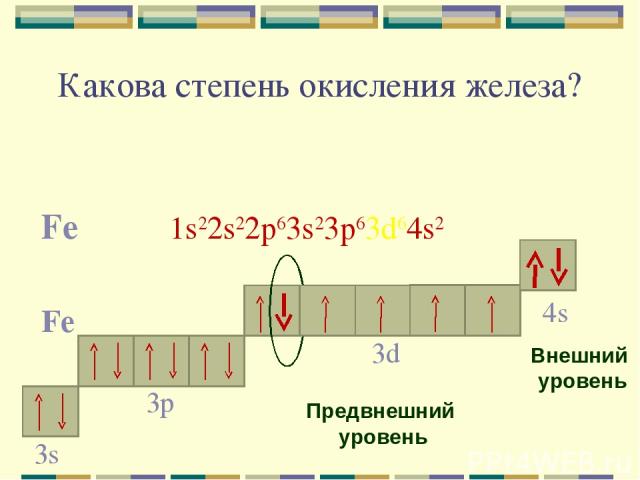
Какова степень окисления железа? Fe 1s22s22p63s23p63d64s2 Fe 4s Внешний уровень 3d Предвнешний уровень 3p 3s

Для железа характерны две основные степени окисления: +2, +3. Fe0 - 2e- = Fe+2 Fe0 - 3e- = Fe+3

Задание: Рассмотрите образец металла (№ 131836). Опишите физические свойства металла (№ 131797).. Используя текст учебник, заполните таблицу: металлический блеск теплопроводность электропроводность пластичность и ковкость магнетизм

Выберите и запишите цифры только тех свойств, которые не относятся к физическим свойствам железа: Серебристо-белый металл Металлический блеск Самый твёрдый металл Tемпература плавления +1540 (№ 131769) Пластичный Легко режется ножом Проводит электрический ток Лёгкий Проводит тепло Легко намагничивается и размагничивается
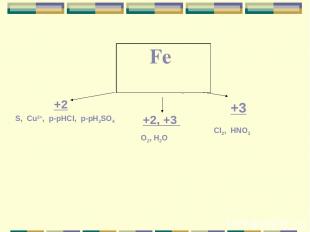
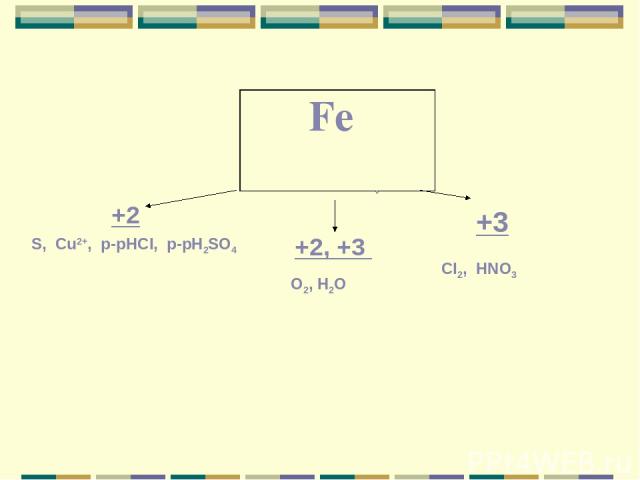
+2 +2, +3 +3 S, Cu2+, p-рHCI, p-рH2SO4 O2, H2O CI2, HNO3 Fe

Химические свойства железа Взаимодействие железа с хлором Видеофрагмент (№ 54490): 2Fe + 3Cl2 = 2FeCl3

Химические свойства железа Взаимодействие железа с кислородом: Видеофрагмент (№ 131824) Fe + O2 = Fe3O4 (FeO*Fe2O3) 3 2

: Какие из реакций соответствуют схеме Fe+2 Fe+3 FeCI2 + CI2 = FeCI3 FeCI3 + NaOH = Fe(OH)3 + 3NaCI Fe(OH)2 + O2 + H2O = Fe(OH)3

Задание: Расставить коэффициенты в уравнениях 1 и 3 методом электронного баланса, определить окислитель и восстановитель в реакции.

Нахождение в природе В земной коре 5,1% железа, 4 место после кислорода, кремния и алюминия. По запасам железных руд Россия занимает 1 место в мире.

Нахождение в природе Метеоритное железо(№ 131727) Запишите не менее 4 -х формул соединений железа, встречающихся в природе

Природные соединения железа Fe FeS Пирит (железный или серный колчедан) FeCO3 Сидерит Fe2O3*3H2O Лимонит (бурый железняк) Fe3O4 (магнитный железняк) Fe2O3 (красный железняк) Железные руды(№ 131728)

Генетические связи Fe - ОТ ЖЕЛЕЗА ДО ОКСИДА ЖЕЛЕЗА (II) (№ 131825) - ОТ ЖЕЛЕЗА ДО ОКСИДА ЖЕЛЕЗА (III) (№ 131874) Пройдите, составив соответствующую схему реакций, от одного указанного в задании вещества к другому:

ПРИМЕНЕНИЕ(№ 207382) Чистое железо способно быстро намагничиваться и размагничиваться, поэтому его применяют для изготовления трансформаторов, электромоторов и мембран микрофонов. Основная масса железа на практике используется в виде сплавов – чугуна и стали. Железо - самый употребляемый металл, на него приходится до 90 % мирового производства металлов.

Домашнее задание § 14, с. 76 -78 № 5 с. 82 - всем № 6 с. 83 (задача), по желанию

Используемая литература: 1. Горковенко М. Ю. Химия. 9 класс. Поурочные разработки к учебнику О. С. Габриеляна (М.: Дрофа); Интернет – ресурсы. www.catalogmineralov.ru – сайт содержит каталог минералов, большую коллекцию фотографий и описание минералов. http://.elementy.ru – сайт « Элементы большой науки», содержит каталоги и статьи научно-популярных журналов «Химия и жизнь», « Наука и жизнь», «Природа» и др. http://www.ovitanah.com - сайт посвящен витаминам и микроэлементам, содержит интересную информацию. http://alhimik.ru – сайт «Алхимик» содержит самую разнообразную информацию по химии. «Химия, 9 класс». Электронная библиотека «Просвещение». ЗАО «Новый диск», 2005 Электронные учебные модули Открытых мультимедиасистем. http://www.mmlab.ru/omschemcat/10p0drazdel31.html 2.Единая коллекция цифровых образовательных ресурсов. Химия, 10 класс. Flash-анимации: Строение атома железа (№ 131835) генетический ряд Fe+2(№ 131825) генетический ряд Fe+3 (№ 131874) Применение железа (№ 207382)

Видеофрагменты: железа с хлором Видеофрагмент (№ 54490)). свойства железа(N 131824) Качественная реакция на ион Fe+2 (№ 54420) Качественная реакция на ион Fe+3(№ 54406) Изображения: образец металла(№ 131836). свойства металла (№ 131797). Температура плавления (№ 131769) Соединения железа (№ 131728) самородное железо (№ 131727)