Презентация на тему: Вода – это жизнь


Девиз урока: Вода – это жизнь!

22 марта — Всемирный день водных ресурсов по календарю ООН, День воды.

Аквариум, Акватория, Акваланг,Акварель.
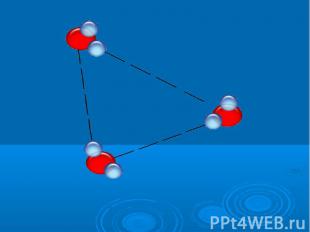
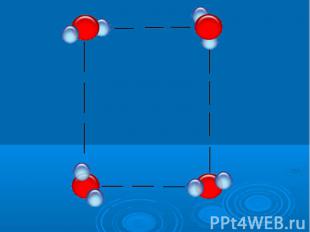

Исследование свойств воды

№1.Вода в природеВелики ли запасы воды на нашей планете? 2. Чего больше на Земле — соленой или пресной воды? 3. Где сосредоточены основные запасы пресной воды?

Вид из космоса

Сколько воды на нашей планете? Общие мировые запасы воды во всех её агрегатных состояниях огромны. Вода относится к числу наиболее распространённых в природе веществ. Общее её количество составляет 1,4 ∙1018 т, она покрывает примерно 4/5 площади земной поверхности. Если бы разделить её поровну, то на каждого жителя планеты пришлось бы по 280 млрд л. Однако, 97% водных ресурсов приходится на долю океанов.

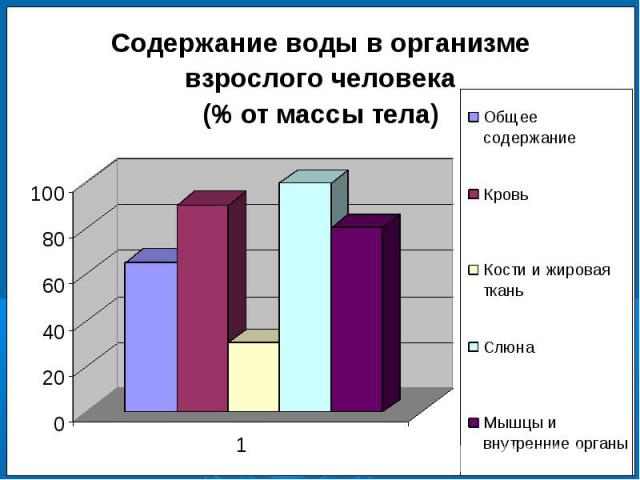
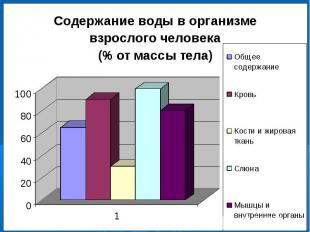
№2Значение воды для жизни организмов1. Какова роль воды в организме человека?2. Зависит ли количество воды в организме от возраста?

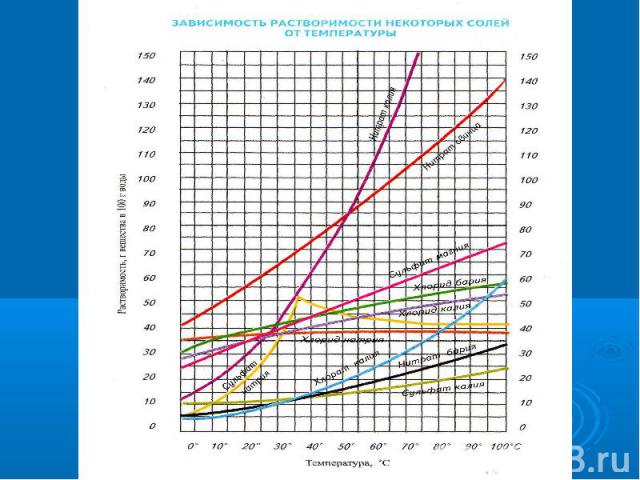
№3Вода — растворительПочему воду называют универсальным растворителем?2. Какой величиной характеризуется способность веществ растворяться в воде?3. Растворимость зависит от температуры?
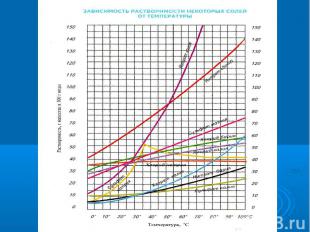

№4Химики-экспериментаторыРастворимость зависит от температуры?От чего еще зависит растворимость ?

Особые свойства воды Видео-1Видео-2

№5Особые свойства водыКакое свойство воды спасает нашу планету от оледенения?2. При какой температуре у воды максимальная плотность? 3. К каким важным последствиям приводит эта аномалия?

Химические свойства воды Она необходима нам всегда.И юный химик, верно, пожелаетУзнать, с чем реагирует водаИ как она в реакции вступает.

Взаимодействие воды с простыми веществами Опишет наша первая главаПроцессы водорода замещения,И как с водой простые веществаВступают в непростые отношения.

1. Реакции воды с металлами Кусочек лития пинцетом взят.Отметьте, что условия обычны.Опустим в воду — тут же результат:Пошла реакция, она экзотермична.Вмиг из воды наш щелочной металлГаз водород активно вытесняет,А тот, ликуя, что свободным стал,Шипит и литий по воде гоняет.Кружит металл, как шаловливый пес,Как будто за хвостом своим гоняясь,Потерю электронов перенес,С гидроксогруппой в щелочь превращаясь:2 Li + 2 HOH = 2 LiOH + H2 + Q.А индикатор проливает светНа появленье оснований сильных:Раствор в малиновый окрасив цвет,Групп подтвердит наличие гидроксильных.

2. Реакции воды с неметаллами И неметаллы могут вытеснятьГаз водород из водяного пара.К примеру, угольки мы можем взять.Но предварительно задав им жару:С + Н2О = СО + Н2.

Взаимодействие воды со сложными веществами Поговорим о сложных веществах.С оксидами сначала разберемся.Причем практически, не на словахВзаимодействия с водой коснемся.

1. Реакции воды с основными оксидами К оксиду кальция воды прилитьВмиг в гидроксид случится превращение.Так мы «пушонку» можем получить,Ведь происходит извести гашение:СаО + Н2O = Са(ОН)2 + Q.

В природе есть железная руда,Железняки — основные оксиды.Так вот, не растворяет их вода.Но мы не держим на нее обиды:Fe2O3 + H2O =Fe3O4 + H2O = Оксид железа (II, III) - магнитный железняк, оксид железа (III) – красный железняк.

2. Реакции воды с кислотными оксидами Нам так приятен летнею поройВкус кислый газированной водицы!А обусловлен он, представьте, кислотой,И знать реакцию вам пригодится.Оксид кислотный — углекислый газ —С водой соединяется охотно.Хоть воду эту пили мы не раз,Не думали, что пьем раствор кислотный.CO2 + H2O = H2CO3

А под ногами нашими песок —Оксид кислотный.Только он едва лиС водой соединиться мог,Не то бы мы по кислоте шагали:Н2О + SiO2 =

Так как же общий вывод прозвучит?У вас уже есть опыт ощутимый:С водой соединяется оксид,Когда продукт реакций — растворимый.