Презентация на тему: Спирты. Предельные одноатомные спирты

СпиртыПредельные одноатомные спирты

Общая характеристика Общая формула гомологического ряда предельных одноатомных спиртов — CnH2n+1OH. В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают спирты первичные (RCH2-OH), вторичные (R2CH-OH) и третичные (R3С-ОН). Простейшие спирты:Первичные: СН3-ОН СН3-СН2-ОН СН3-СН2-СН2-ОНметанол этанол пропанол-1
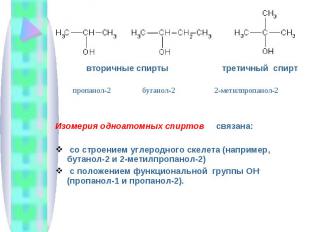
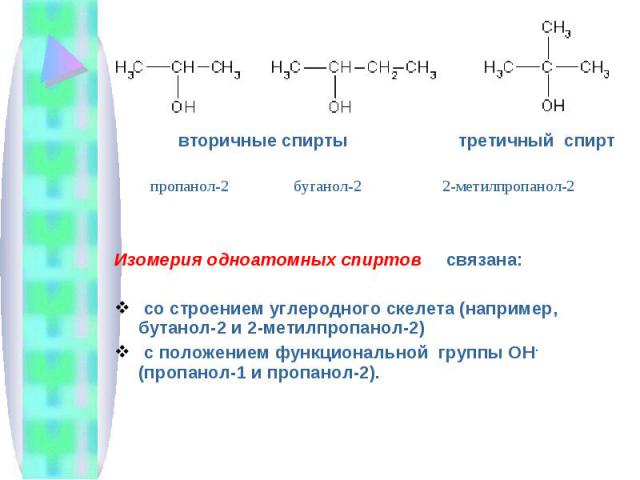
вторичные спирты третичный спирт Изомерия одноатомных спиртов связана: со строением углеродного скелета (например, бутанол-2 и 2-метилпропанол-2) с положением функциональной группы ОН - (пропанол-1 и пропанол-2).

Названия спиртов образуют, добавляя окончание -ол к названию углеводорода с самой длинной углеродной цепью, включающей гидроксильную группу. Нумерацию цепи начинают с того края, ближе к которому расположена гидроксильная группа. Кроме того, широко распространена заместительная номенклатура, по которой название спирта производится от соответствующего углеводородного радикала с добавлением, слова "спирт", например: C2H5OH — этиловый спирт.

Низшие спирты (до C15) — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде падает. По сравнению с соответствующими углеводородами, спирты имеют высокие температуры плавления и кипения, что объясняется сильной ассоциацией молекул спирта в жидком состоянии за счет образования водородных связей .

Образование водородных связей Образование водородной связи между молекулами спирта … между молекулами воды … между молекулами спирта и воды
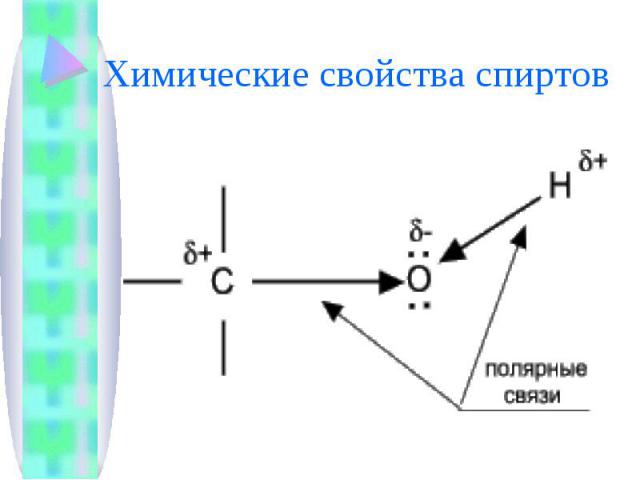
Химические свойства спиртов

Химические свойства спиртов определяются присутствием в их молекулах гидроксильной группы ОН-. Связи С-О и О- Н сильно полярны и способны к разрыву. Различают два основных типа реакций спиртов с участием функциональной группы –ОН-: Реакции с разрывом связи О-Н-: (здесь проявляются слабые кислотные свойства спиртов) взаимодействие спиртов с щелочными и щелочноземельными металлами с образованием алкоголятов; реакции спиртов с органическими и минеральными кислотами с образованием сложных эфиров; окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений. Скорость реакций, при которых разрывается связь О-Н, уменьшается в ряду: первичные спирты > вторичные > третичные.

Реакции сопровождающиеся разрывом связи С-О: (здесь проявляются слабые основные свойства спиртов)внутримолекулярная дегидратация с образованием алкеновмежмолекулярная дегидратация: с образованием простых эфиров взаимодействие с галогеноводородами и их концентрированными растворами с образованием алкилгалогенидов. Скорость реакций, при которых разрывается связь С-О, уменьшается в ряду: третичные спирты > вторичные > первичные.Спирты являются амфотерными соединениями.

1. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют со щелочными металлами: 2С2Н5-ОН + 2K→ 2С2Н5-ОK + Н2↑С увеличением длины углеводородного радикала скорость этой реакции замедляетсяСпирты не взаимодействуют со щелочамиВ присутствии следов влаги соли спиртов (алкоголяты) разлагаются до исходных спиртов: С2Н5ОK + Н2О → С2Н5ОН + KОН. Это доказывает, что спирты — более слабые кислоты, чем вода.2. При действии на спирты минеральных и органических кислот образуются сложные эфиры. Образование сложных эфиров протекает по механизму нуклеофильного присоединения-отщепления : С2Н5ОН + СН3СООН СН3СООС2Н5 + Н2О Этилацетат C2H5OH + HONO2 C2H5ONO2 + Н2O Этилнитрат

Отличительной особенностью первой из этих реакций является то, что атом водорода отщепляется от спирта, а группа ОН-- от кислоты. (Установлено экспериментально методом "меченых атомов" ).3. Спирты окисляются под действием дихромата или перманганата калия до карбонильных соединений. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты: [O] [О]R-CH2-OH → R-CH=O → R-COOH. спирт альдегид карбоновая кислота
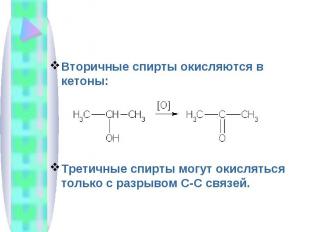
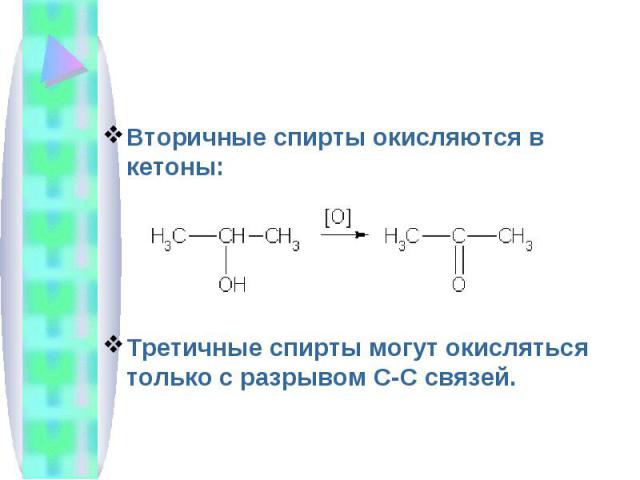
Вторичные спирты окисляются в кетоны:Третичные спирты могут окисляться только с разрывом С-С связей.

Реакции с разрывом связи С-О. Реакции дегидратации протекают при нагревании спиртов с водоотнимающими веществами. При сильном нагревании происходит внутримолекулярная дегидратация с образованием алкенов: H2SO4 ,t >140°ССН3-СН2-СН2-ОН → СН3-СН=СН2 + Н2О.При более слабом нагревании происходит межмолекулярная дегидратация с образованием простых эфиров: H2SO4,t< 140°С2CH3-CH2-OH → C2H5-O-C2H5 + H2O. Спирты обратимо реагируют с галогеноводородными кислотами (здесь проявляются слабые основные свойства спиртов): ROH + HCl RCl + Н2ОТретичные спирты реагируют быстро, вторичные и первичные - медленно.

1. Самый общий способ получения спиртов, имеющий промышленное значение, — гидратация алкенов. Реакция идет при пропускании алкена с парами воды над фосфорнокислым катализатором: H3PO4 СН2=СН2 + Н2О → СН3—СН2—ОН.Из этилена получается этиловый спирт, из пропена — изопропиловый. Присоединение воды идет по правилу Марковникова, поэтому из первичных спиртов по данной реакции можно получить только этиловый спирт.2. Другой общий способ получения спиртов — гидролиз алкилгалогенидов под действием водных растворов щелочей: R—Br + NaOH → R—OH + NaBr.По этой реакции можно получать первичные, вторичные и третичные спирты.

3. Восстановление карбонильных соединений. При восстановлении альдегидов образуются первичный спирты, при восстановлении кетонов — вторичные:R—CH=O + Н2 → R—CH2—OH, (1)R—CO—R' + Н2 → R—CH(OH) —R'. (2)Реакцию проводят, пропуская смесь паров альдегида или кетона и водорода над никелевым катализатором.4. Действие реактивов Гриньяра на карбонильные соединения .5. Этанол получают при спиртовом брожении глюкозы:С6Н12О6 → 2С2Н5ОН + 2СО2↑.

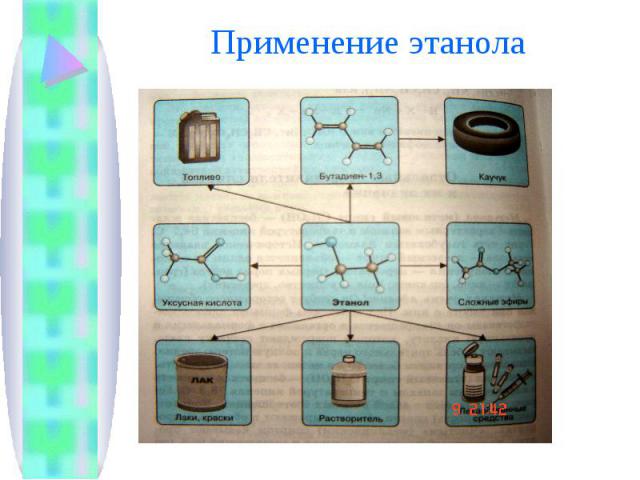
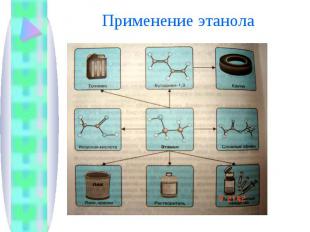
Спирты главным образом используют в промышленности органического синтеза. Этанол - важное сырье пищевой промышленности.
Применение этанола