Презентация на тему: Соли. Названия и классификация солей

Презентация по химии «Соли. Названия и классификация солей»

Солями называются вещества, в которых атомы металла связаны с кислотными остатками. Общая формула класса: MenAm

Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы NH4+. Примеры типичных солей приведены ниже. NaCl – хлорид натрия, Na2SO4 – сульфат натрия, СаSO4 – сульфат кальция, СаCl2 – хлорид кальция, (NH4)2SO4 – сульфат аммония.

Формула соли строится с учетом валентностей металла и кислотного остатка. Практически все соли – ионные соединения, поэтому можно говорить, что в солях связаны между собой ионы металла и ионы кислотных остатков: Na+Cl– – хлорид натрия Ca2+SO42– – сульфат кальция и т.д.
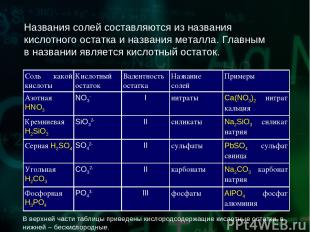
Названия солей составляются из названия кислотного остатка и названия металла. Главным в названии является кислотный остаток. В верхней части таблицы приведены кислородсодержащие кислотные остатки, в нижней – бескислородные. Соль какой кислоты Кислотный остаток Валентность остатка Название солей Примеры Азотная HNO3 NO3- I нитраты Ca(NO3)2 нитрат кальция Кремниевая H2SiO3 SiO32- II силикаты Na2SiO3 силикат натрия Серная H2SO4 SO42- II сульфаты PbSO4 сульфат свинца Угольная H2CO3 CO32- II карбонаты Na2CO3 карбонат натрия Фосфорная H3PO4 PO43- III фосфаты AlPO4 фосфат алюминия

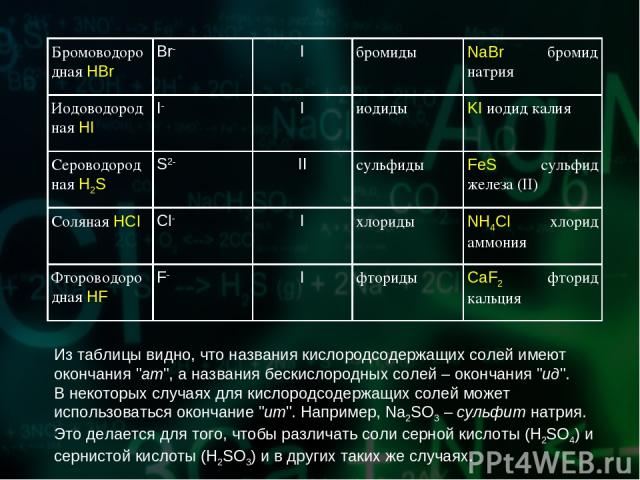
Из таблицы видно, что названия кислородсодержащих солей имеют окончания "ат", а названия бескислородных солей – окончания "ид". В некоторых случаях для кислородсодержащих солей может использоваться окончание "ит". Например, Na2SO3 – сульфит натрия. Это делается для того, чтобы различать соли серной кислоты (H2SO4) и сернистой кислоты (H2SO3) и в других таких же случаях. Бромоводородная HBr Br- I бромиды NaBr бромид натрия Иодоводородная HI I- I иодиды KI иодид калия Сероводородная H2S S2- II сульфиды FeS сульфид железа (II) Соляная HCl Cl- I хлориды NH4Cl хлорид аммония Фтороводородная HF F- I фториды CaF2 фторид кальция

Классификация солей В зависимости от состава соли бывают: 1. Средние – продукт полного замещения водорода в кислоте металлом. 2KOH + H2CO3 = K2CO3 + 2H2O карбонат калия 2. Кислые - продукт неполного замещения водорода в кислоте металлом. NaOH + H2CO3 = NaHCO3 + H2O гидрокарбонат натрия

Классификация солей 3. Основные – продукт неполного замещения групп OH- основания на кислотный остаток. Mg(OH)2 + HCl = MgOHCl + H2O гидроксохлорид магния 4. Двойные – состоящие из различных атомов металлов и общего кислотного остатка. K2SO4 + Al2(SO4)3 = 2KAl(SO4)2 сульфат алюминия - калия

Классификация солей 5. Смешанные – состоящие из общего металла и различных кислотных остатков. CuOHNO3 + CH3COOH = CuCH3COONO3 + H2O нитрат-ацетат меди (II) 6. Комплексные – содержащие сложные ионы. K4 [Fe(CN)6] жёлтая кровяная соль

Строение солей аналогично строению соответствующих кислот и оснований. Ниже приведены структурные формулы типичных средних, кислых и основных солей.

Получение солей Соли получают при химическом взаимодействии соединений различных классов и простых веществ. Отметим важнейшие способы получения солей.

Получение солей 1. Реакция нейтрализации: Ca(OH)2 + H2CO3 = = CaCO3 + 2H2O карбонат кальция

Получение солей 2. Взаимодействие металлов с неметаллами: 2Al + 3S = Al2S3 сульфид алюминия

Получение солей 3. Взаимодействие металлов с кислотами: Zn + 2HCl = ZnCl2 + H2 хлорид цинка

Получение солей 4. Взаимодействие основных оксидов с кислотными оксидами. CaO + SiO2 = CaSiO3 силикат кальция 5. Взаимодействие оснований с кислотными оксидами. Ca(OH)2 + CO2 = CaCO3 + H2O карбонат кальция

Физические свойства солей Соли, за небольшим исключением, являются твёрдыми кристал-лическими веществами различного цвета. По растворимости в воде их делят на: растворимые малорастворимые нерастворимые

Химические свойства солей Соли взаимодействуют: C простыми веществами – металлами и неметаллами. со сложными – кислотами, основаниями и солями.

Химические свойства солей 1. С металлами: CuSO4 + Fe = FeSO4 + Cu сульфат меди (II) сульфат железа (II) 2. С неметаллами: 2KI + Br2 = 2KBr + I2 иодид калия бромид калия

Химические свойства солей 3. С кислотами: 2NaCl + H2SO4 = хлорид натрия = Na2SO4 + 2HCl сульфат натрия

Химические свойства солей 4. С щелочами: FeCl2 + 2NaOH = хлорид железа (II) =Fe(OH)2 + 2NaCl хлорид натрия

Химические свойства солей 5. С солями: AgNO3 + KCl = нитрат серебра =AgCl + KNO3 хлорид серебра

Применение солей Многие соли применяют в быту (поваренная соль, сода), в качестве минеральных удобрений, при производстве стекла, моющих средств, взрывчатых веществ.








![Классификация солей 5. Смешанные – состоящие из общего металла и различных кислотных остатков. CuOHNO3 + CH3COOH = CuCH3COONO3 + H2O нитрат-ацетат меди (II) 6. Комплексные – содержащие сложные ионы. K4 [Fe(CN)6] жёлтая кровяная соль Классификация солей 5. Смешанные – состоящие из общего металла и различных кислотных остатков. CuOHNO3 + CH3COOH = CuCH3COONO3 + H2O нитрат-ацетат меди (II) 6. Комплексные – содержащие сложные ионы. K4 [Fe(CN)6] жёлтая кровяная соль](https://fs3.ppt4web.ru/images/132012/171372/640/img8.jpg)