Презентация на тему: Соединения галогенов

Соединения галогенов

План урока 1. Галогеноводородные кислоты.2. Соляная кислота и её свойства.3. Соли галогеноводородных кислот. Галогениды. Качественные реакции на галогенид-ионы.4. Природные соединения галогенов. 5. Рефлексия. 6. Подведение итогов.7. Домашнее задание.
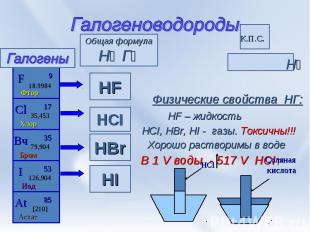
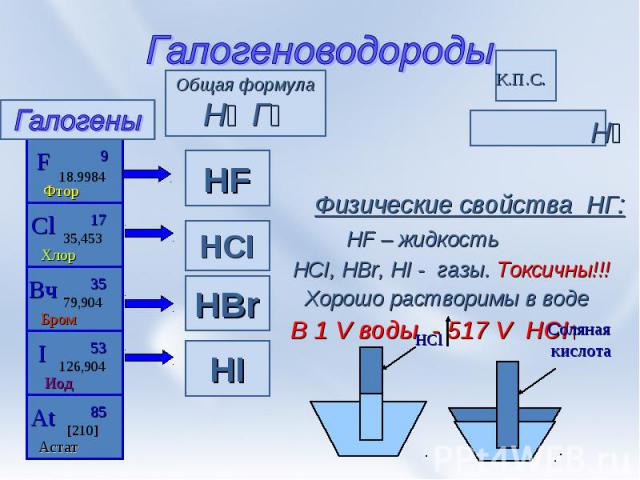
Галогеноводороды Н⁺ ª→ Г⁻ª Физические свойства НГ: HF – жидкость HCI, HBr, HI - газы. Токсичны!!! Хорошо растворимы в воде В 1 V воды - 517 V HCI↑

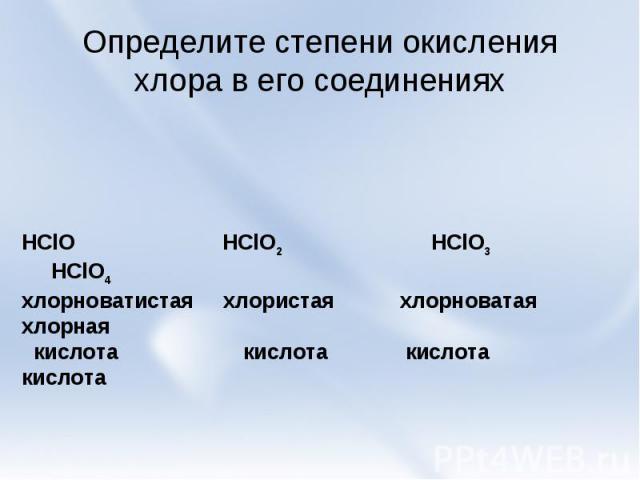
Определите степени окисления хлора в его соединениях HClO HClO2 HClO3 HClO4хлорноватистая хлористая хлорноватая хлорная кислота кислота кислота кислота
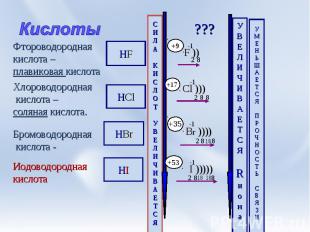
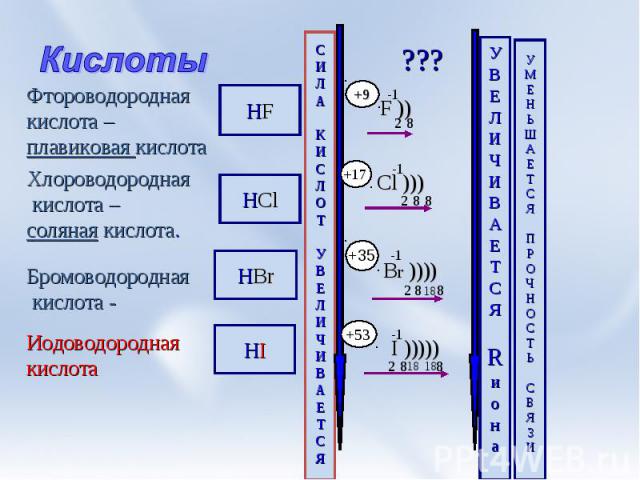
Кислоты Фтороводородная кислота –плавиковая кислота Хлороводородная кислота –соляная кислота. Бромоводородная кислота - Иодоводороднаякислота
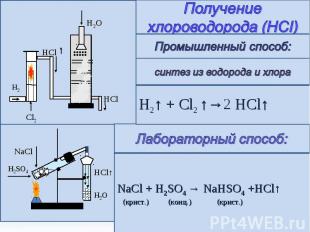
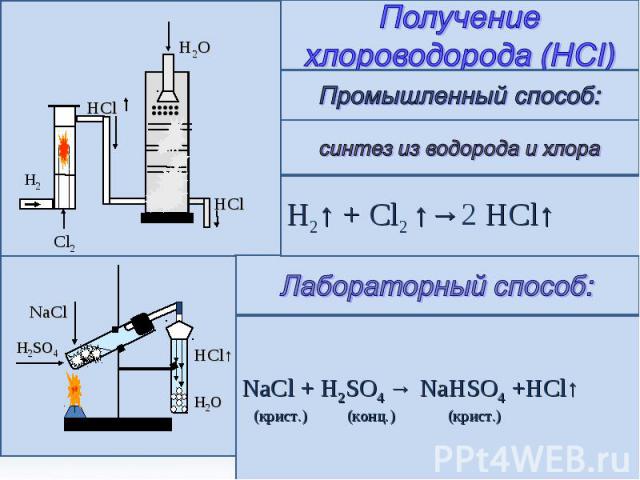
Получение хлороводорода (HCI) Промышленный способ: синтез из водорода и хлора H2↑ + Cl2 ↑→2 HCl↑ Лабораторный способ: NaCl + H2SO4 → NaHSO4 +HCl↑ (крист.) (конц.) (крист.)

Соляная кислота - HCL Свойства 1.Изменяет цветиндикаторов 2.Ме (до Н2) 3.Основные оксиды 4.Основания 5.Соли(более слабых кислот) Домашнее задание:Составить уравнения реакций,подтверждающие химические свойства соляной кислоты

Галогеноводородные кислоты
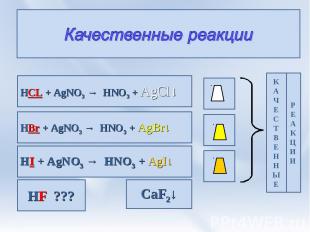
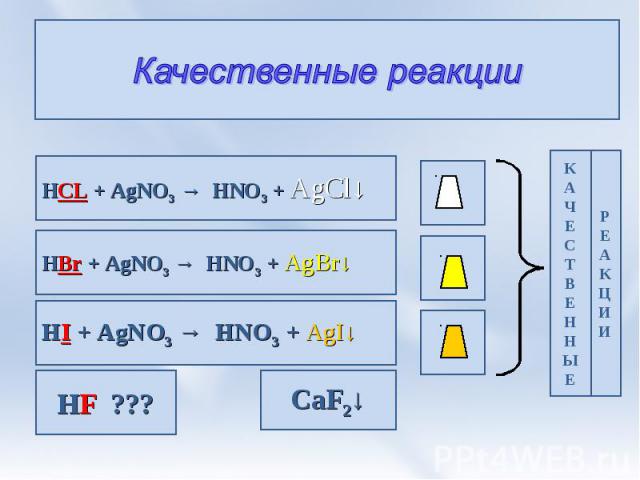
Качественные реакции HCL + AgNO3 → HNO3 + AgCl↓ HBr + AgNO3 → HNO3 + AgBr↓ HI + AgNO3 → HNO3 + AgI↓
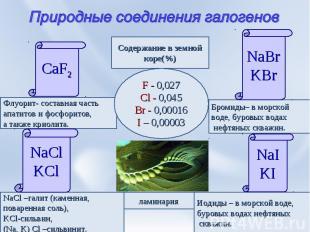
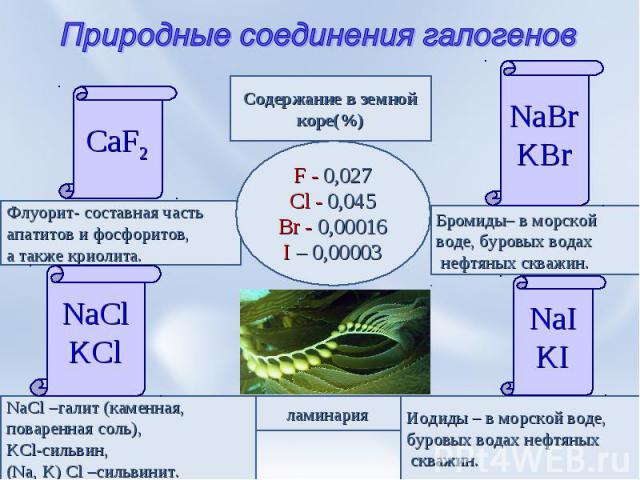
Природные соединения галогенов CaF2 Флуорит- составная частьапатитов и фосфоритов,а также криолита. NaCl –галит (каменная, поваренная соль),KCl-сильвин,(Na, K) Cl –сильвинит. Иодиды – в морской воде,буровых водах нефтяных скважин. NaIKI Бромиды– в морской воде, буровых водах нефтяных скважин. NaBrKBr Содержание в земнойкоре(%) F - 0,027Cl - 0,045Br - 0,00016I – 0,00003
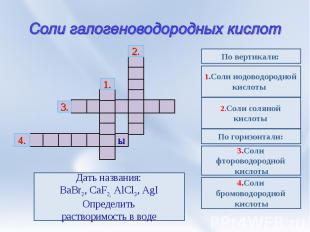
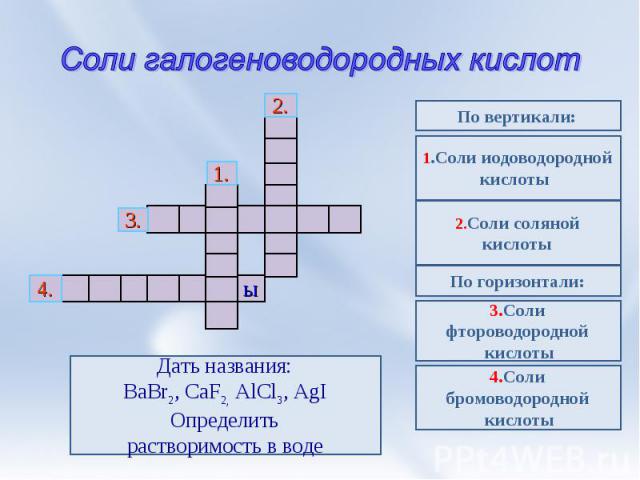
Соли галогеноводородных кислот Дать названия:BaBr2, CaF2, AlCl3, AgIОпределитьрастворимость в воде 1.Соли иодоводороднойкислоты 2.Соли соляной кислоты По горизонтали: 3.Соли фтороводородной кислоты 4.Соли бромоводородной кислоты