Презентация на тему: Реакции ионного обмена

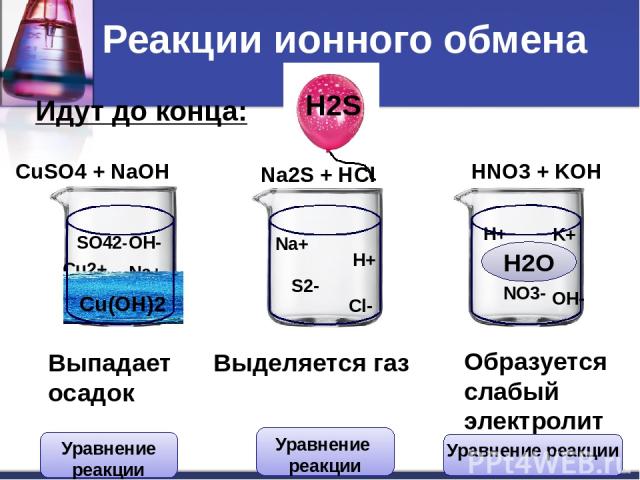
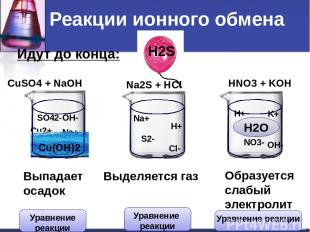
Идут до конца: CuSO4 + NaOH Na2S + HCl HNO3 + KOH Cu2+ SO42- Na+ OH- Na+ S2- H+ Cl- H+ NO3- K+ OH- Сu(OH)2 H2S H2O Выпадает осадок Выделяется газ Образуется слабый электролит Реакции ионного обмена Уравнение реакции Уравнение реакции Уравнение реакции

Интернет -ресурсы http://www.openclass.ru/node/53366(таблица растворимости Баженов А.А.) http://shopfurniture.ru/?ps_category=kofeiniki-i-vse-dlya-kofe&paged=2 (стакан) http://vsem-darom.ru/products/categories/3199/severodvinsk (шарик) http://do.gendocs.ru/docs/index-265718.html (лестница успеха) http://ru.123rf.com/photo_8623287_3d-human-ladder-wall-success-business-up-red.html (человечек с портфелем) http://krasnoyarsk.pulscen.ru/products/sulfougol_11329010 Сульфоуголь http://promtek-k.ru/index/sulfougol/0-170 (сульфоуголь) http://novostey.com/other/news384529.html (Сахар) http://www.artfile.ru/b.php?i=719068(фруктовые соки) http://жарптица24.рф/product/bakaleya/konservatsiya_molochnaya/moloko_sguschennoe_tselnoe_glavprodukt_8_5__380gr(сгущеное (молоко) https://ru.wikipedia.org/wiki/Иониты (Зёрна ионита) http://www.voda-eko.ru/ionoobmennaya-smola-dlya-filtrov.html(Ионообменная смола) http://www.aqua-therm.ru/articles/articles_217.html(Иониты) http://kiev.all.biz/napolniteli-dlya-tualeta-domashnih-zhivotnyh-bgc4142(цеолит) http://biobeauty.by/sostav-i-deysavie-masok-biobeauty.html (строение цеолита) http://visfox-oster.blogspot.ru/2012/04/blog-post_12.html (иониты)
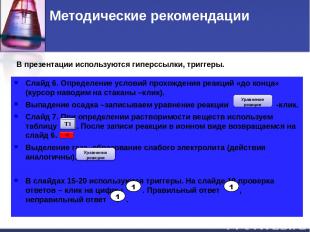
Методические рекомендации Слайд 6. Определение условий прохождения реакций «до конца» (курсор наводим на стаканы –клик). Выпадение осадка –записываем уравнение реакции -клик. Слайд 7. При определении растворимости веществ используем таблицу . После записи реакции в ионном виде возвращаемся на слайд 6. Выделение газа, образование слабого электролита (действия аналогичны). В слайдах 15-20 используются триггеры. На слайде 19 проверка ответов – клик на цифры . Правильный ответ , неправильный ответ . Уравнение реакции В презентации используются гиперссылки, триггеры.

Алгоритм составления уравнений Молекулярное уравнение CuSO4+2NaOH = Cu(OH)2 + Na2SO4 Полное ионное уравнение Сокращенное ионное уравнение Cu 2+ + SO4 2- + 2 Na + + 2 OH - = Cu(OH)2 + 2 Na + + SO4 2- Cu 2+ + 2OH - = Cu(OH)2 1.Записать уравнение реакции в молекулярном виде 2.По таблице растворимости определить растворимость каждого вещества 3.Составить полное ионное уравнение (записать диссоциацию растворимых исходных веществ и продуктов реакции) 4.Найти одинаковые ионы в левой и правой частях, сократить их и записать сокращенное ионное уравнение Т1
Составление уравнений Молекулярное уравнение HNO3+KOH = KNO3 + H2O Полное ионное уравнение Сокращенное ионное уравнение H + + NO3 - + K + + OH - = H2O + K + + NO3 - H + + OH - = H2O Т3

Составление уравнений Молекулярное уравнение Na2SO4+2KNO3 2NaNO3 + K2SO4 Полное ионное уравнение 2Na + + SO4 2- + 2 K + + 2 NO3 - + 2 K + + SO4 2- 2 NO3 - Na + + 2 Обратимые реакции – реакции, идущие во взаимно противоположных направлениях Т4
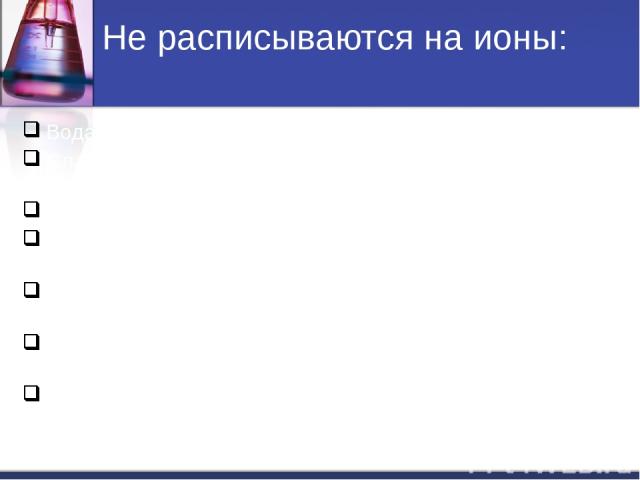
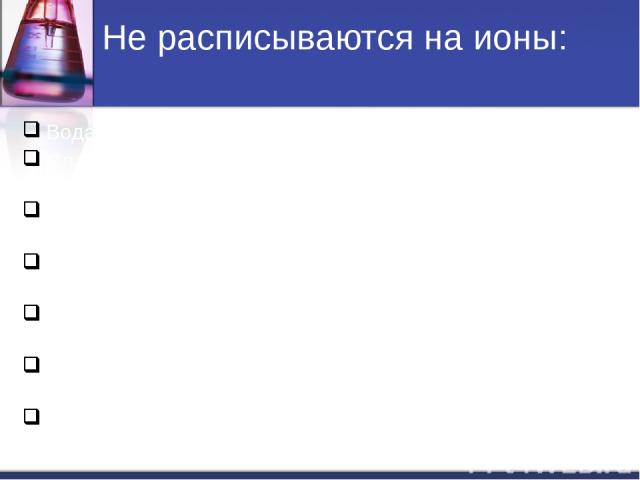
Не расписываются на ионы: Вода H2O. Слабые кислоты (HNO2, H2CO3, H2SO3, CH3COOH и др.). Слабые основания (NH4OH, Fe(OH)2, Cu(OH)2, и др.). Нерастворимые соли(↓): (AgCl , BaSO4, CaCO3, FeS и др.). Амфотерные гидрооксиды (↓): Al(OH)3, Zn(OH)2, Cr(OH)3 и др. Газообразные вещества( CO2, SO2, H2, H2S, NH3 и др.). Оксиды металлов и неметаллов (Li2O, MgO, P2O5, SiO2, и т.д).

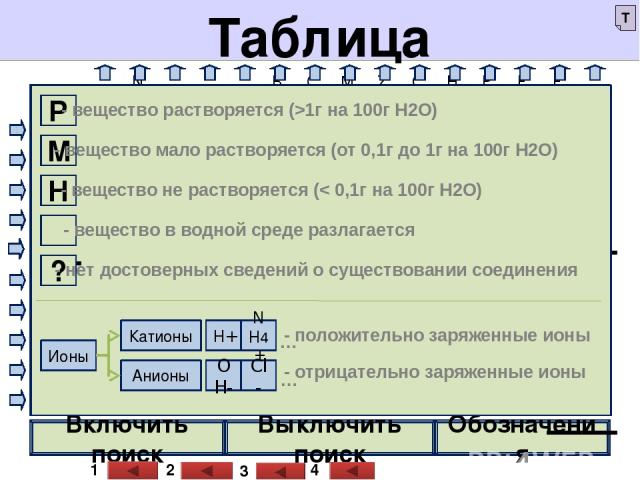
Выключить поиск Включить поиск Обозначения Баженов А.А. Баженов А.А. _ Р Р _ Р М Н Н Н _ Н Н Н Н Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Р Н Р Р Р Р Р Р М Р Р Р Р Р Р Р Н Р М Н Н Н Н Н Н _ _ Р Р Р Р Н М М М М ? Н Н М ? ? Р Р Р Р М Н М Р Р Р _ Н Р Р Р Р Р Р Р Н Н Н Н Н Н ? Н Н ? ? Н ? Р Р ? Н Н Н Н ? ? Н Н ? ? Р _ Р Р Н Н Н Н Н Н Н Н Н Н Н Р Р Р Р Р Р Р Р Р Р Р Р Р _ _ Баженов А.А. Таблица растворимости . OH- Ионы NO3- Cl- S2- SO32- SO42- CO32- SiO32- PO43- CH3COO- H+ NH4+ K+ Na+ Ag+ Ba2+ Ca2+ Mg2+ Zn2+ Cu2+ Hg2+ Pb2+ Fe2+ Fe3+ Al3+ OH- H+ Ионы Баженов А.А. NO3- Cl- S2- SO32- SO42- CO32- SiO32- PO43- CH3COO- NH4+ K+ Na+ Ag+ Ba2+ Ca2+ Mg2+ Zn2+ Cu2+ Hg2+ Pb2+ Fe2+ Fe3+ Al3+ Т 1 2 3 4 Р - вещество растворяется (>1г на 100г Н2О) М - вещество мало растворяется (от 0,1г до 1г на 100г Н2О) Н - вещество не растворяется (< 0,1г на 100г Н2О) _ - вещество в водной среде разлагается ? - нет достоверных сведений о существовании соединения Ионы Катионы Анионы - положительно заряженные ионы - отрицательно заряженные ионы H+ NH4+ … OH- Cl- …

Не расписываются на ионы: Вода H2O. Слабые кислоты (HNO2, H2CO3, H2SO3, CH3COOH и др.). Слабые и нерастворимые основания (NH4OH, Fe(OH)2, Cu(OH)2, и др.). Нерастворимые соли(↓): (AgCl , BaSO4, CaCO3, FeS и др.). Амфотерные гидрооксиды (↓): (Al(OH)3, Zn(OH)2, Cr(OH)3 и др.). Газообразные вещества( CO2, SO2, H2, H2S, NH3 и др.). Оксиды металлов и неметаллов (Li2O, MgO, P2O5, SiO2, и др.).

Обратимые реакции Na2SO4 + KNO3 Na+ SO42- K+ NO3- 1.Нет осадка 2.Не выделяется газ 3.Не образуется слабый электролит
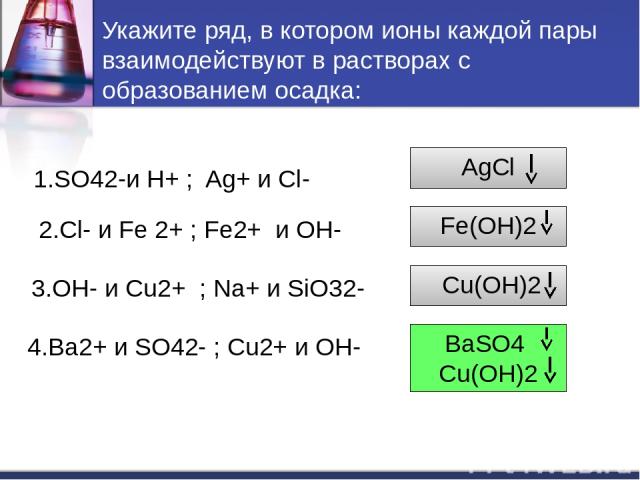
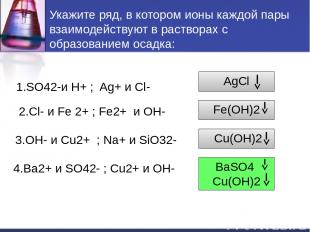
Укажите ряд, в котором ионы каждой пары взаимодействуют в растворах с образованием осадка: 1.SO42-и H+ ; Ag+ и Cl- 2.Cl- и Fe 2+ ; Fe2+ и OH- 3.OH- и Cu2+ ; Na+ и SiO32- 4.Ba2+ и SO42- ; Cu2+ и OH- AgCl Fe(OH)2 Cu(OH)2 BaSO4 Cu(OH)2

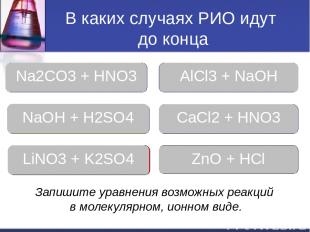
В каких случаях РИО идут до конца Молодец Молодец Молодец Ошибка Ошибка Молодец Na2CO3 + HNO3 AlCl3 + NaOH NaOH + H2SO4 CaCl2 + HNO3 LiNO3 + K2SO4 ZnO + HCl Запишите уравнения возможных реакций в молекулярном, ионном виде.

Сокращенное ионное уравнение реакции соответствует взаимодействию: 2H+ + CO32- = CO2 + H2O 1.2HNO3 + CaCO3 = Ca(NO3)2 + CO2 + H2O 2.2HCl + MgCO3 = MgCl2 + CO2 + H2O 3.H2SO4 + CaCO3 = CaSO4 + CO2 + H2O 4.2HCL + Na2CO3 = 2NaCL + CO2 + H2O Правильно Ошибка
Сокращенное ионное уравнение реакции соответствует взаимодействию: Al2O3 + 6H+ = 2Al3+ + 6H2O 1.Al2O3 + 3CO2 = Al2(CO3)3 2.Al(NO3)3 + 3KOH = 3KNO3 + Al(OH)3 3.Al2O3 + 3H2SO4 = Al2(SO4)3 + 6H2O 4.AlCL3 + H2O = AlOHCl2+ + HCl Правильно Ошибка
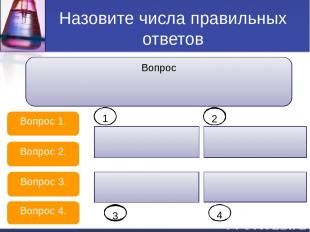
Назовите числа правильных ответов 1.Выберите ряд, в котором каждое вещество не записывается в виде ионов при составлении ионных уравнений. Вопрос 1. Вопрос 2. Вопрос 3. Вопрос 4. H2S, Na2S, CuSO4 CO2, H2SiO3, H2SO3 KCl, Ca(HCO3)2, HI H2CO3, K2CO3, Cu(OH)2 1 2 3 4 Сокращенное ионное уравнение H+ + OH- = H2O соответствует реакции: H2SO4+Zn(OH)2 HCl + Al(OH)3 HNO3 + NaOH H2CO3 + KOH 1 2 3 4 Выберите пары веществ, которые в водном растворе взаимодействуют с образованием газа. Na2SO3 и HNO3 KHCO3 и HCl NaHS и NaOH NaHS и H2SO4 1 2 3 4 Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции Fe(OH)3 + H2SO4= равны соответственно: 28 и 3 22 и 16 28 и 18 14 и 10 1 2 3 4 Вопрос

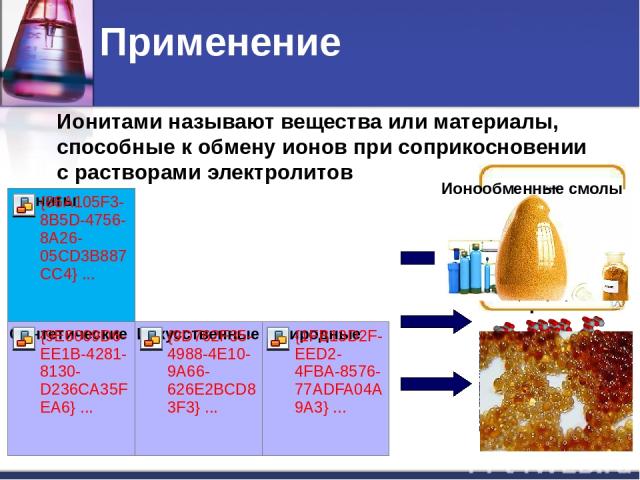
Применение Ионитами называют вещества или материалы, способные к обмену ионов при соприкосновении с растворами электролитов Цеолит Ионообменные смолы

Применение ионитов Для уменьшения жёсткости воды путём замены обусловливающих её ионов кальция и магния на другие, например, натрия. Для обессоливания воды, при этом удаляются и катионы, и анионы путём последовательного прохождения воды через катионит и анионит. Для обезжелезивания воды особую роль играет возможность катионов удалять двухвалентное железо. Очистка сточных вод промышленных предприятий. Очистка воды
Применение ионитов В пищевой промышленности: 1.Очистка соков в производстве сахара. 2.В производстве дрожжей, фруктовых соков, глицерина, глюкозы, сгущенного молока, какао, кофе со сгущенным молоком.

Применение ионитов Для извлечения металлов С помощью ионитов извлекаются редкие и рассеянные элементы из полиметаллических руд. В сельском хозяйстве иониты используются для доставки растениям необходимых им элементов. Mo W

Лестница успеха 1 2 3 4 5 6 Выберите свой уровень успеха

Интернет -ресурсы http://www.uefima.ru/health/xranenie-donorskoj-krovi.html(хранение крови) http://youreld.clan.su/?page2(пенициллин) http://ogorod01.narod.ru/obschie_podkormka_rasteniy.html (растение) http://www.tiensmed.ru/news/tetraciklinus1.html (тетрациклин) http://www.periodictable.ru/074W/W.html (Молибден, вольфрам)

Литература Неорганическая химия(в схемах, рисунках, таблицах, формулах, химических реакциях), А.П. Гаршин, «Лань» Санкт-Петербург,2000г Книга для чтения по неорганической химии. В. А. Крицман, Москва «Просвещение»1994г. Химия 8 класс. О.С. Габриелян, Москва «ДРОФА» 2014г.