Презентация на тему: Периодический закон химической таблицы Менделеева

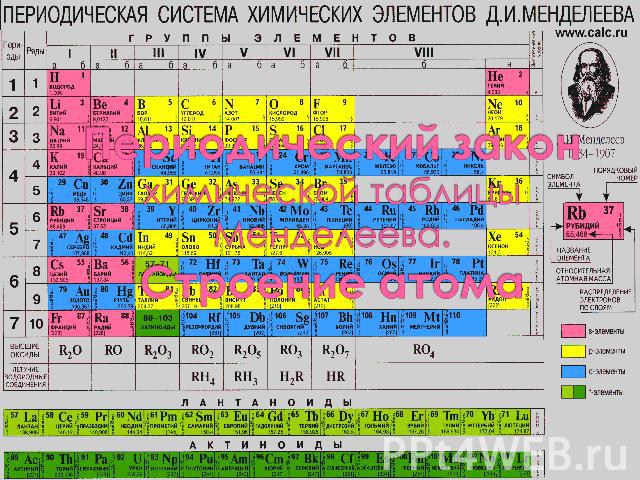
Периодический закон химической таблицы Менделеева Периодический закон Д. И. Менделеева — фундаментальный за-кон, устанавливающий периодическое изме-нение свойств хими-ческих элементов в за-висимости от увеличе-ния зарядов ядер их атомов.

Памятник Д.И. Менделееву в Санкт-Петербурге

Периодический закон открыт Д. И. Менделеевым в марте 1869 года при сопоставлении свойств всех известных в то время элементов и величин их атомных масс (весов). Термин «периодический закон» Мен-делеев впервые употребил в ноябре 1870, а в октябре 1871 дал окончатель-ную формулировку Периодического закона: «…свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в пе-риодической зависимости от их атомного веса». Графическим (табличным) выраже-нием периодического закона является разработанная Менделеевым перио-дическая система элементов.

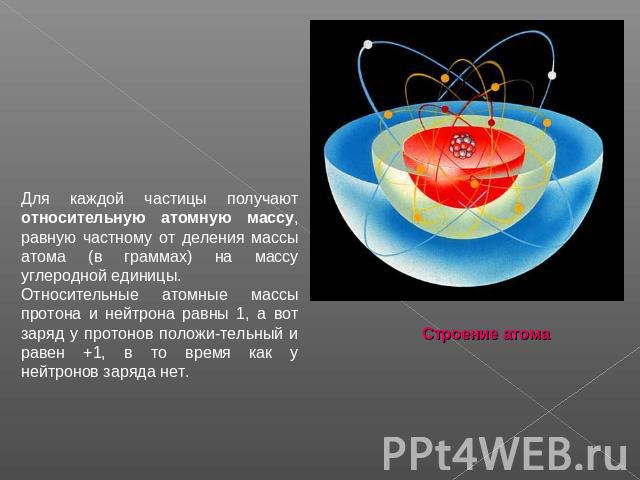
Строение атома Атомы - мельчайшие частицы вещества.Если увеличить до размеров Земного шара яблоко средней величины, то атомы станут размером всего лишь с яблоко. Несмотря на столь малые размеры, атом состоит из еще более мелких физических частиц атома. В составе атома есть ядро и электроны, которые вращаются вокруг ядра так быстро, что становятся неразличимыми - образуют "электронное облако", или электронную оболочку

Электроны принято обозначать так: e−. Электроны e− очень легкие, почти невесомые, но зато имеют отрицательный электрический заряд. Он равен −1. Электрический ток, которым все мы пользуемся - это поток электронов, бегущий в проводах. Ядро атома, в котором сосредоточена почти вся его масса, состоит из частиц двух сортов - нейтронов и протонов. Нейтроны обозначают так: n0, а протоны так: p+ . По массе нейтроны и протоны почти одинаковы - 1,675 · 10−24 г и 1,673 · 10−24 г. Правда, считать массу таких маленьких частиц в граммах очень неудобно, поэтому ее выражают в углеродных единицах, каждая из которых равна 1,673 · 10−24 г.

Для каждой частицы получают относительную атомную массу, равную частному от деления массы атома (в граммах) на массу углеродной единицы. Относительные атомные массы протона и нейтрона равны 1, а вот заряд у протонов положи-тельный и равен +1, в то время как у нейтронов заряда нет.