Презентация на тему: Описание получения апатита
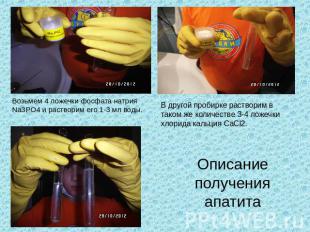
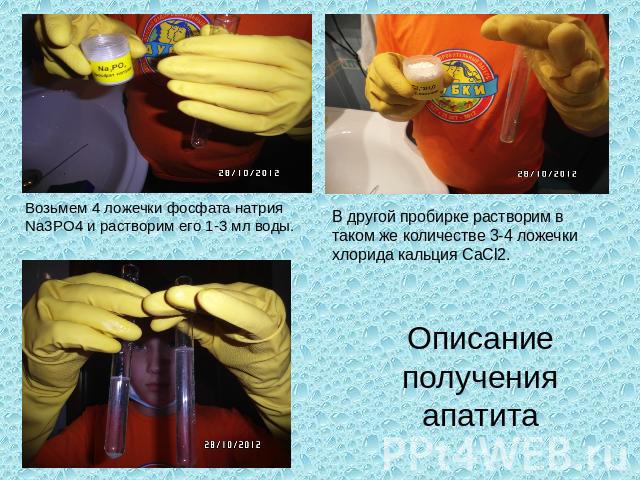
Возьмем 4 ложечки фосфата натрия Na3PO4 и растворим его 1-3 мл воды. В другой пробирке растворим в таком же количестве 3-4 ложечки хлорида кальция CaCl2. Описание получения апатита

Выливаем раствор хлорида кальция в раствор фосфата натрия . Выпадает осадок апатита : 4NA₃PO₄ +5CaCL₂ +H₂O = = Ca₅(OH)(PO₄)₃↓ +10NaCl + Na₂HPO₄ Даем осадку отстояться 15 минут.В принципе по всем правилам, надо слить оставшуюся жидкость, но поскольку у нас вся пробирка заполнена веществом, то мы добавляем в пробирку 2-3 мл соляной кислоты HCL.

При добавлении соляной кислоты видно, что осадок растворяется (фото в низу и наверху). Это апатит превратился в растворимый дигидрофосфат кальция Ca(H2PO₄)2 :Ca₅(OH)(PO₄)₃ +14HCl=3 Ca(H2PO₄)2 + 2H2O +7CaCl2

Коррозия (ржавление) металла Коррозия-это разрушение металлов под действием различных агентов окружающей среды
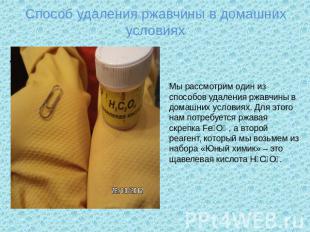
Способ удаления ржавчины в домашних условиях Мы рассмотрим один из способов удаления ржавчины в домашних условиях. Для этого нам потребуется ржавая скрепка Fe₃O₄ , а второй реагент, который мы возьмем из набора «Юный химик» – это щавелевая кислота H₂C₂O₄.

Насыпаем в пробирку 0,5 см щавелевой кислоты и наливаем воды на четверть по высоте пробирки. Фото вверху слева.Затыкаем пробирку пробкой и перемешиваем, чтобы кислота растворилась. Фото внизу слева.Теперь в чашку Петри положим заржавевшую скрепку и зальем раствором кислоты. Фото внизу.

Примерно через час, а может быть и раньше, ржавчина исчезнет. Fe₃O₄ +5H₂C₂O₄ = FeC₂O₄ + 2Н [Fe(C₂O₄)₂] +4H₂O

Гашение соды уксусом Для нашего «кулинарного» опыта возьмем обычную питьевую соду и разведенный 9% - ый уксус, который мы используем для приготовления различных блюд Дальше все очень просто, берем половинку чайной ложки пищевой соды и добавляем в нее соду и разведенный 9% - ый уксус.

Гашение соды широко применяется в кулинарии, в основном в выпечке изделий из теста. Чтобы тесто было пышным, необходим разрыхлитель. Самым доступным разрыхлителем, который можно изготовить в домашних условиях, является сода, гашеная уксусом .При соприкосновении с кислой средой сода вступает с ней в реакцию, распадаясь на соль, воду и углекислый газ. Этот самый углекислый газ и разрыхляет тесто, придавая ему пышность и пористость. В основе гашения соды лежит химическая реакция с выделением углекислого газа (СО2) Химическая формула гашения соды уксусом выглядит так:Na₂CO₃ + 2CH₃ — COOH = 2 CH₃ — COONa + H₂O + CO₂






![Примерно через час, а может быть и раньше, ржавчина исчезнет. Fe₃O₄ +5H₂C₂O₄ = FeC₂O₄ + 2Н [Fe(C₂O₄)₂] +4H₂O Примерно через час, а может быть и раньше, ржавчина исчезнет. Fe₃O₄ +5H₂C₂O₄ = FeC₂O₄ + 2Н [Fe(C₂O₄)₂] +4H₂O](/images/1194/31851/640/img6.jpg)













