Презентация на тему: Металлы. Химические и физические свойства металлов

МЕТАЛЛЫ Химические и физические свойства металлов

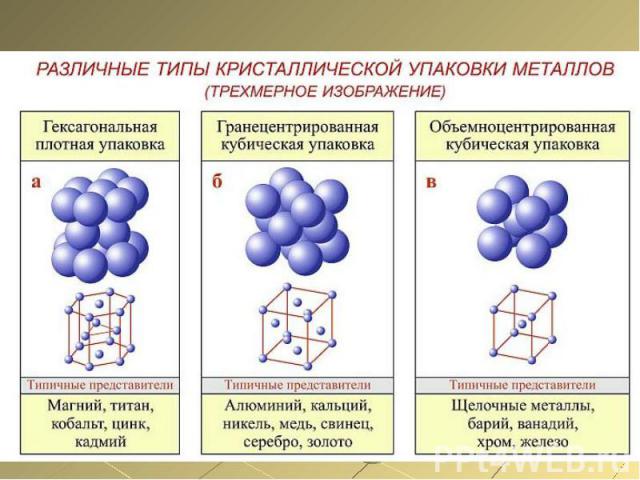
Физические свойства металлов Очень важным свойством металлов является их сравнительно легкая механическая деформируемость. Металлы пластичны, они хорошо куются, вытягиваются в проволоку, прокатываются в листы и т.п.

Все металлы имеют характерный металлический блеск.

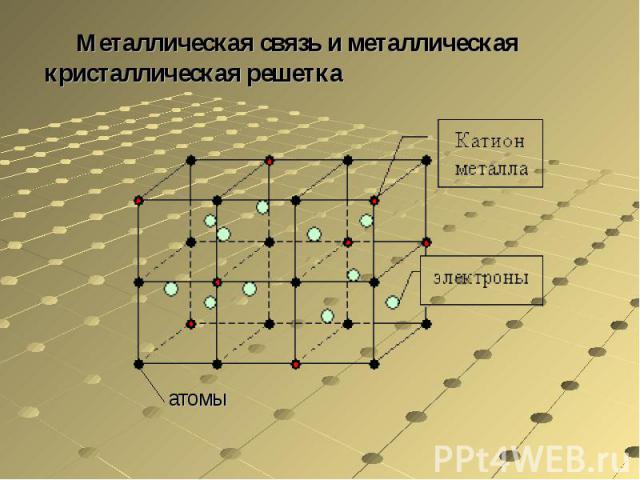
Частицы металлов, находящихся в твердом и жидком состоянии, связаны особым типом химической связи — так называемой металлической связью. Она определяется одновременным наличием обычных ковалентных связей между нейтральными атомами и кулоновским притяжением между ионами и свободными электронами. Таким образом, металлическая связь является свойством не отдельных частиц, а их агрегатов.
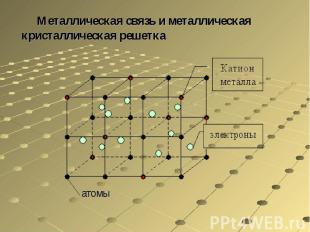
Металлическая связь и металлическая кристаллическая решетка
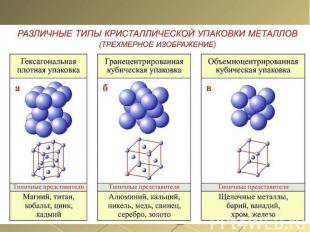

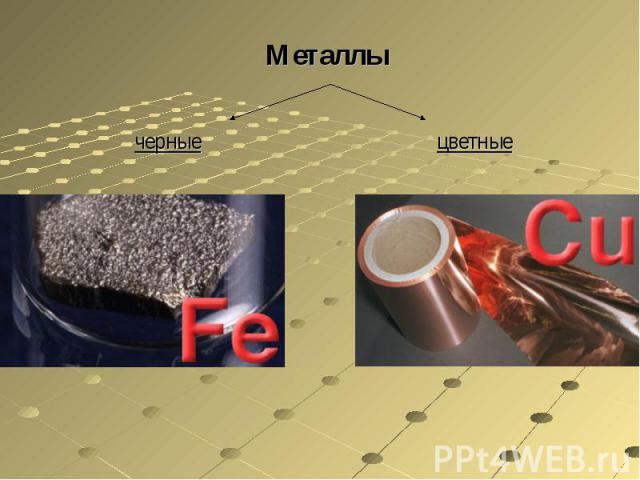
Металлычерныецветные

Плотность и температура плавления некоторых металлов.

Металлы легкие( плотность не более 5 г/см3 )тяжелые( плотность больше 5 г/см3 )

Металлы мягкиетвердые

Металлы легкоплавкие( t пл < 1539 0С )тугоплавкие( t пл > 1539 0С )

Химические свойства металлов Основным химическим свойством металлов является способность их атомов легко отдавать свои валентные электроны и переходить в положительно заряженные ионы. Типичные металлы никогда не присоединяют электронов; их ионы всегда заряжены положительно.

1. Взаимодействие с неметаллами. Закончите уравнения химических реакций. Дайте названия образующимся веществам:Mg + O2 Al + O2Cu + SK + CL2Ca + P Взаимодействие алюминия с бромом Разберите данную реакцию с т. з. окисления-восстановления

Взаимодействие железа с серой Разберите данную реакцию с т. з. окисления-восстановления.

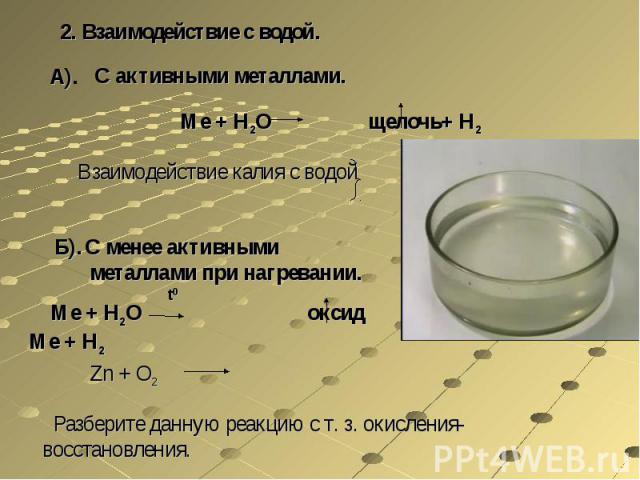
2. Взаимодействие с водой.С активными металлами.Ме + Н2О щелочь+ Н2Взаимодействие калия с водойС менее активными металлами при нагревании. Ме + Н2О оксид Ме + Н2Zn + O2 Разберите данную реакцию с т. з. окисления-восстановления.

3. Взаимодействие с кислотами. Металлы, стоящие в ряду активности до водорода, вытесняют его из кислот (исключение - азотная кислота и концентрированная серная кислота).Взаимодействие железа с разбавленной серной кислотойЗапишите уравнение реакции и разберите её с т. з. окисления-восстановления.

4. Взаимодействие с солями.Взаимодействие железа с медным купоросом.Взаимодействие меди с нитратом ртути (II). Запишите уравнения реакций и разберите одну из них с т. з. окисления-восстановления.

Выводы:1. Химические свойства металлов определяются строением их атомов и строением простого вещества металл.2. При химических реакциях атомы металлов являются восстановителями, окисляясь при этом.3. Активность металлов зависит: А) от числа валентных электронов – чем их меньше, тем металл активнее; Б) от удаленности валентных электронов от ядра – чем дальше, тем металл активнее.

КОНЕЦ