Презентация на тему: Коллоидная химия

Коллоидная химияКоллоидная химия – наука о поверхностных явлениях и дисперсных системах.Поверхностные явления – совокупность явлений, связанных с физическими особенностями границ раздела между соприкасающимися фазами.Дисперсные системы – гетерогенные системы, в которых одна из фаз находится в дисперсном (раздробленном состоянии).Дисперсная системаДисперсная фаза(раздробленная частьдисперсной системы)Дисперсионная среда(непрерывная часть дисперсной системы)

Признаки объектов коллоидной химии1. Гетерогенность (многофазность).2. Дисперсность (раздробленность).

Меры дисперсности Поперечный размер частицы (а) – диаметр для сферических частиц (d) и длина ребра для кубических частиц (l).Дисперсность (D) – величина, обратная поперечному размеру частицы: D=1/a.Удельная поверхность (Sуд) – межфазная поверхность, приходящаяся на единицу объема или массы дисперсной фазы:
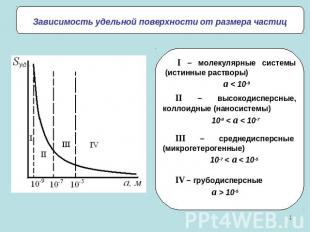
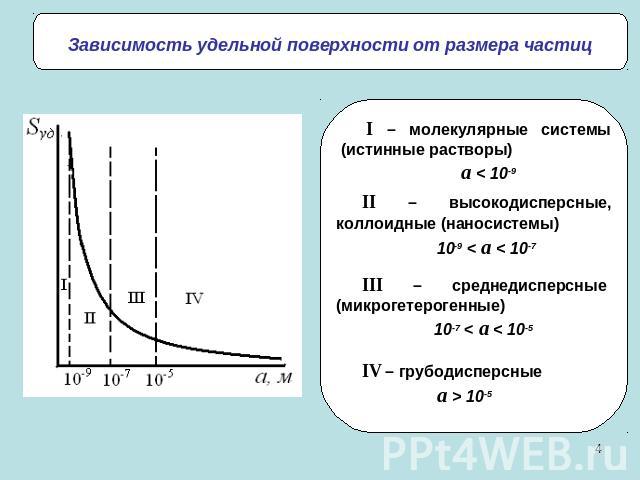
Зависимость удельной поверхности от размера частицI – молекулярные системы (истинные растворы)a < 10-9II – высокодисперсные, коллоидные (наносистемы)10-9 < a < 10-7III – среднедисперсные (микрогетерогенные)10-7 < a < 10-5IV – грубодисперсныеa > 10-5

Пример: Дисперсность частиц коллоидного золота 108 м-1. Принимая частицы золота в виде кубиков определить, какую поверхность они могут покрыть, если их плотно уложить в один слой. Масса коллоидных частиц золота 1 г. Плотность золота 19,6·103 кг/м3.Решение: 1. Общая поверхность частиц коллоидного золота S = Sуд·V.2. Удельная поверхность кубических частиц Sуд = 6D.3. Объем золота равен V = m/ρ.Тогда:

Особенности коллоидных систем1. Избыточная поверхностная энергия GS При увеличении дисперсности увеличивается удельная поверхность частиц дисперсной фазы, большая часть всех молекул или атомов находится на поверхности раздела фаз в несимметричном силовом поле, что приводит к возникновению избыточной поверхностной энергии
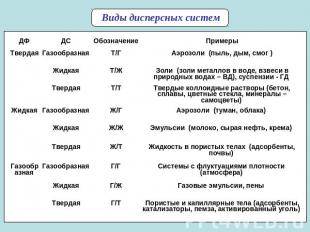
Виды дисперсных систем

Получение дисперсных системДиспергационные методыизмельчение крупных образцов вещества до частиц дисперсных размеров; химический состав и агрегатное состояние вещества не меняется; затрачивается внешняя работа;используют для получения грубодисперсных систем – производство цемента (1 млрд.т в год), измельчении руд полезных ископаемых, помол муки и т.д.

Для облегчения диспергирования используют понизители твердости (электролиты, эмульсии, ПАВ и др.) Понизители твердости составляют 0,1 % от общей массы измельчаемых веществ и при этом снижают энергозатраты на получение дисперсных систем более чем в два раза.

Конденсационные методыоснованы на ассоциации молекул в агрегаты из истинных растворов; используют для получения высокодисперсных систем; не требуют затраты внешней работы; появление новой фазы происходит при пересыщении среды.

Стадии конденсации1. Зародышеобразование - возникновение центров кристаллизации в пересыщенном растворе; зародыши образуются тем легче, чем больше чужеродных частиц.2. Рост зародышей.3. Формирование слоя стабилизатора (ДЭС).

Физические конденсационные методы1. Метод конденсации из паров – образование тумана в газовой фазе при понижении температуры. Образование тумана, облаков, производство H2SO4, H3PO4.2. Метод замены растворителя – раствор вещества приливают к жидкости, в которой это вещество практически не растворимо. Получение гидрозолей серы, холестерина, канифоли и др

Химические конденсационные методыМетоды основаны на образовании м.р.с. в результате протекания химических реакций. 1. Реакции восстановления (получение золей Au, Ag, Pt).Восстановление аурата натрия формальдегидом.2NaAuO2 + 3HCOH + Na2CO3 = 2Au + 3HCOONa +NaHCO3 + H2OСтроение мицеллы :

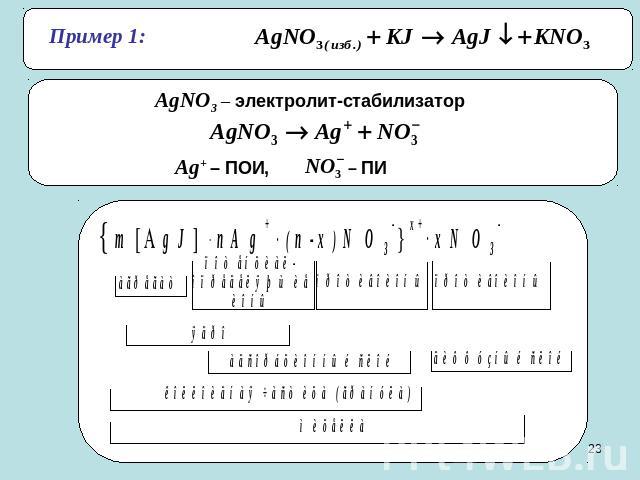
2. Реакции обмена. Получение золя иодида серебра.AgNO3 + KJ(изб.) = AgJ↓ + KNO3Строение мицеллы:

3. Реакции окисленияОбразование золя серы.2H2Sр-р + O2 = 2S ↓+ 2H2OСтроение мицеллы:

4. Реакции гидролизаПолучение золя гидроксида железа.FeCl3 + 3H2O = Fe(OH)3 ↓ + 3HClCтроение мицеллы:

Метод пептизацииПептизация – метод, основанный на переводе в коллоидный раствор осадков, первичные размеры которых уже имеют размеры высокодисперсных систем.Суть метода: свежевыпавший рыхлый осадок переводят в золь путем обработки пептизаторами (растворами электролитов, ПАВ, растворителем).

Методы очистки дисперсных системНизкомолекулярные примеси (чужеродные электролиты) разрушают коллоидные системы. Диализ – отделение золей от низкомолекулярных примесей с помощью полупроницаемой мембраны.Электродиализ – диализ, ускоренный внешним электрическим полем.Ультрафильтрация – электродиализ под давлением (гемодиализ).

Особенности коллоидных растворовОпалесценция (светорассеяние) наблюдается когда λ > d. Чем короче длина волны падающего света, тем больше рассеяние. 400 нм - синий, 780 нм - красныйПри боковом свечении дисперсные системы имеют голубоватую окраску (атмосфера Земли), а в проходящем свете – красноватую (восход и закат Солнца).
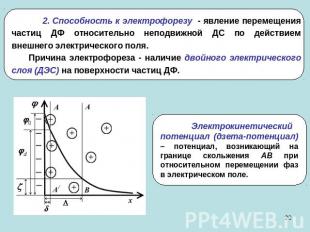
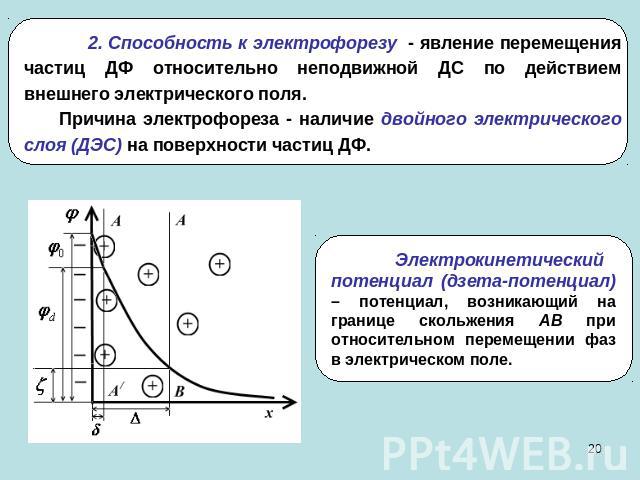
2. Способность к электрофорезу - явление перемещения частиц ДФ относительно неподвижной ДС по действием внешнего электрического поля. Причина электрофореза - наличие двойного электрического слоя (ДЭС) на поверхности частиц ДФ.Электрокинетический потенциал (дзета-потенциал) – потенциал, возникающий на границе скольжения АВ при относительном перемещении фаз в электрическом поле.
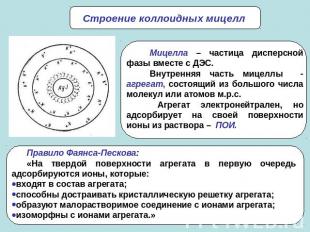
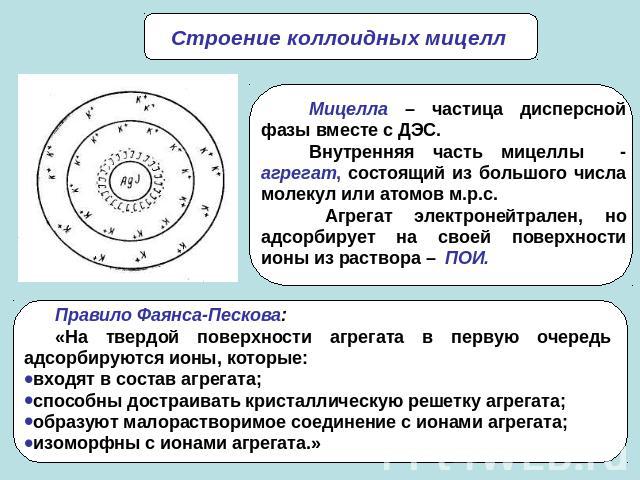
Строение коллоидных мицеллМицелла – частица дисперсной фазы вместе с ДЭС.Внутренняя часть мицеллы - агрегат, состоящий из большого числа молекул или атомов м.р.с. Агрегат электронейтрален, но адсорбирует на своей поверхности ионы из раствора – ПОИ.Правило Фаянса-Пескова: «На твердой поверхности агрегата в первую очередь адсорбируются ионы, которые:входят в состав агрегата;способны достраивать кристаллическую решетку агрегата;образуют малорастворимое соединение с ионами агрегата;изоморфны с ионами агрегата.»

Агрегат вместе с ПОИ составляет ядро мицеллы. Заряженное ядро мицеллы, притягивает ПИ из раствора. Часть ПИ образует адсорбционный слой. Ядро с ПИ плотной части ДЭС образуют гранулу или коллоидную частицу. Знак заряда коллоидной частицы определяется знаком заряда ПОИ. Коллоидную частицу окружают ПИ диффузной слоя – остальная часть ПИ, подвергающихся броуновскому движению и менее прочно связанная с ядром. В целом образуется мицелла. Мицелла в отличие от коллоидной частицы электронейтральна.
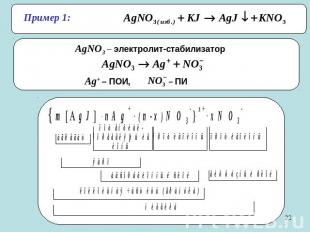
Пример 1:

Устойчивость и коагуляция дисперсных системУстойчивость – неизменность во времени основных параметров дисперсной системы: степени дисперсности и равномерного распределения частиц дисперсной фазы в дисперсионной среде.Коагуляция – процесс разрушения коллоидных систем за счет слипания частиц, образования более крупных агрегатов с потерей устойчивости и последующим разделением фаз.

Коагуляция золей электролитамиПравила электролитной коагуляцииВсе электролиты при определенной концентрации могут вызвать коагуляцию золя.Правило знака заряда: коагуляцию золя вызывает тот ион электролита, знак заряда которого противоположен заряду коллоидной частицы. Этот ион называют ионом-коагулятором.Каждый электролит по отношению к коллоидному раствору обладает порогом коагуляции (коагулирующей способностью).

Порог коагуляции (γ, Скр) – наименьшая концентрация электролита, достаточная для того, чтобы вызвать коагуляцию золяКоагулирующая способность (Р) – величина, обратная порогу коагуляции Влияние заряда иона-коагулятора (правило Шульце-Гарди): коагулирующая способность электролита возрастает с увеличением заряда иона – коагулятора

Пример решения заданияЗоль гидроксида цинка получен путем сливания растворов ZnCl2 и NaOH. Определите знак заряда коллоидной частицы, напишите формулу мицеллы, если пороги коагуляции растворов электролитов следующие:Решение: Определим знак заряда частиц золя.Так как анионы всех электролитов одновалентны, а их пороги коагуляции разные, то коагуляцию золя вызывают катионы электролитов. В данном случае: чем выше заряд катиона, тем меньше порог коагуляции (справедливо правило Шульце – Гарди). Следовательно, согласно «правилу знака заряда», заряд коллоидной частицы отрицательный.Следовательно, ПОИ – ОН-, ПИ – Na+.