Презентация на тему: Гидролиз

Гидролиз

Гидролиз – это реакции обменного Взаимодействия вещества с водой, приводящие к их разложению. Гидролизу подвергаются соединения различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. В общем виде гидролиз можно представить уравнением: где А—В — гидролизующееся вещество, А—Н и В—ОН — продукты гидролиза
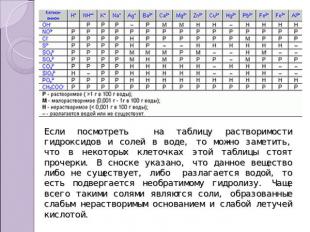
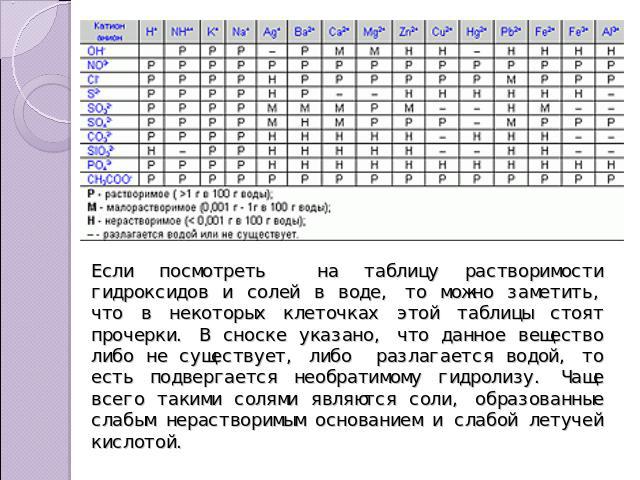
Если посмотреть на таблицу растворимости гидроксидов и солей в воде, то можно заметить, что в некоторых клеточках этой таблицы стоят прочерки. В сноске указано, что данное вещество либо не существует, либо разлагается водой, то есть подвергается необратимому гидролизу. Чаще всего такими солями являются соли, образованные слабым нерастворимым основанием и слабой летучей кислотой.

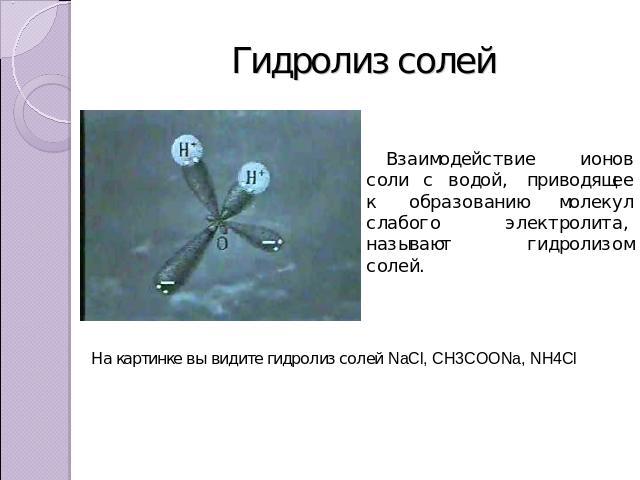
Гидролиз солей Взаимодействие ионов соли с водой, приводящее к образованию молекул слабого электролита, называют гидролизом солей. На картинке вы видите гидролиз солей NaCl, CH3COONa, NH4Cl

Количественной характеристикой Гидролиза солей может служить степень гидролиза (a), определяемая отношением концентрации гидролизованной части молекул к общей концентрации данной соли в растворе; в большинстве случаев она невелика. Так, в 0,1 молярных растворах ацетата натрия CH3COONa или хлорида аммония NH4CI при 25 °С a = 0,01%, а для ацетата аммония CH3COONH4 a = 0,5%. С повышением температуры и разбавлением раствора степень Гидролиз увеличивается.

Гидролиз солей лежит в основе многих важных процессов в химической промышленности и лабораторной практике. Частичный Гидролиз трёхкальциевого силиката является причиной выделения свободной извести при взаимодействии портландцемента с водой (см. Цемент). Благодаря Гидролиз возможно существование буферных систем, способных поддерживать постоянную кислотность среды. Такие растворы имеют и очень важное физиологическое значение — постоянная концентрация ионов Н+ необходима для нормальной жизнедеятельности организма. С Гидролиз солей связан ряд геологических изменений земной коры и образование минералов, формирование природных вод и почв.

Различают несколько вариантов гидролиза солей: 1. Гидролиз соли слабой кислоты и сильного основания: Na2CO3 + Н2О = NaHCO3 + NaOH CO32- + H2O = HCO3- + OН- (раствор имеет щелочную реакцию, реакция протекает обратимо) 2. Гидролиз соли сильной кислоты и слабого основания: СuСl2 + Н2О = CuOHCl + HCl Cu2+ + Н2О = CuOH+ + Н+ (раствор имеет кислую реакцию, реакция протекает обратимо) 3. Гидролиз соли слабой кислоты и слабого основания: Al2S3 + 6H2O = 2Al(OН)3 + 3H2S 2Аl3+ + 3S2- + 6Н2О = 2Аl(OН)3(осадок) + ЗН2S(газ)

Гидролиз - процесс обратимый. Повышение концентрации ионов водорода и гидроксид-ионов препятствует протеканию реакции до конца. Параллельно с гидролизом проходит реакция нейтрализации, когда образующееся слабое основание (Мg(ОН)2, Fe(ОН)2 ) взаимодействует с сильной кислотой, а образующаяся слабая кислота ( СН3СООН, Н2СО3 ) - со щелочью. Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота: Al2S3 + 6H2O =>2Al(OH)3 + 3H2S

При гидролизе жиров в присутствии щелочей получают мыла. Гидролиз жиров в присутствии катализаторов применяется для получения глицерина и жирных кислот.
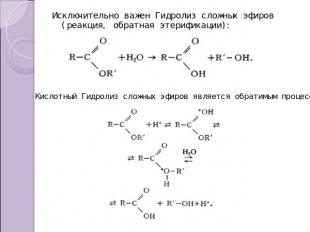
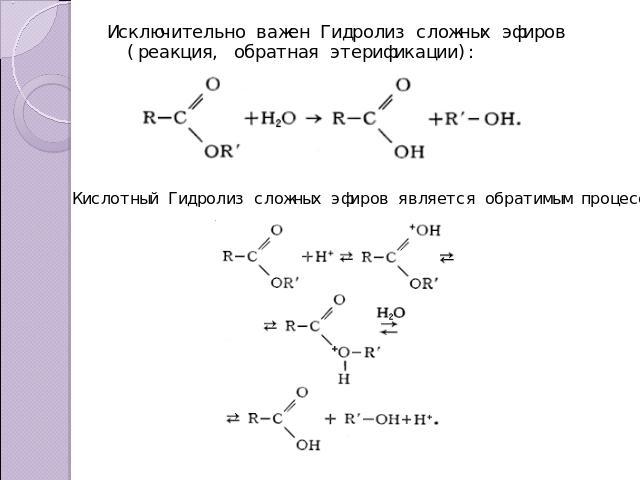
Исключительно важен Гидролиз сложных эфиров (реакция, обратная этерификации): Кислотный Гидролиз сложных эфиров является обратимым процессом:

Термин «Гидролиз» обычно применяется в органической химии также по отношению к некоторым процессам, которые более правильно было бы называть гидратацией; примером может служить превращение нитрилов кислот в амиды

Таким образом, можно сделать вывод о том, что гидролиз по праву считается одним из самых важных процессов в природе.Явление гидролиза следует учитывать при приготовлении растворов. Для предотвращения гидролиза растворы солей, подвергающиеся гидролизу по катиону, необходимо подкислять.