Презентация на тему: Срс

Антибактериальная терапия , принципы лечения. Выполнила: Каппасова А.М Проверил:

Нижние дыхательные пути Мочевыводящие пути Кожа и мягкие ткани Органы брюшной полости ОСНОВНЫЕ ИСТОЧНИКИ ИНФЕКЦИИ

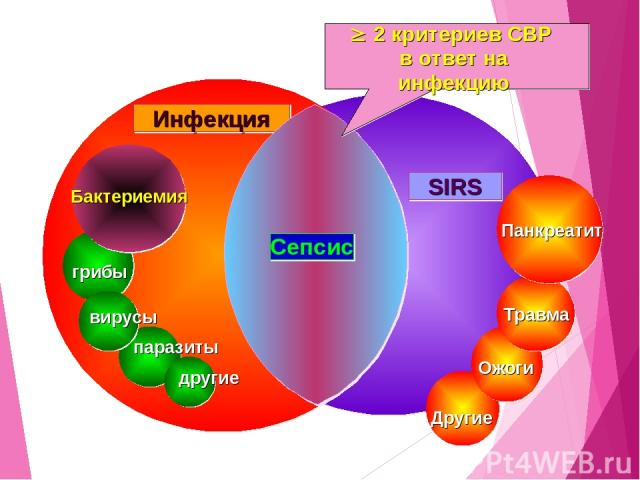
СОГЛАСНО ЭТОЙ КЛАССИФИКАЦИИ ВЫДЕЛЯЮТ: Синдром системной воспалительной реакции Сепсис Тяжелый сепсис Септический шок

СИНДРОМ СИСТЕМНОЙ ВОСПАЛИТЕЛЬНОЙ РЕАКЦИИ «Systemic Inflammatory Response Syndrome» (SIRS) – неспецифическая системная реакция организма на воздействие различных повреждающих факторов (инфекция, травма, операция и др.)
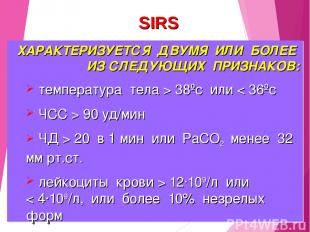
ХАРАКТЕРИЗУЕТСЯ ДВУМЯ ИЛИ БОЛЕЕ ИЗ СЛЕДУЮЩИХ ПРИЗНАКОВ: температура тела > 38ºс или < 36ºс ЧСС > 90 уд/мин ЧД > 20 в 1 мин или РаСО2 менее 32 мм рт.ст. лейкоциты крови > 12·109/л или < 4·109/л, или более 10% незрелых форм SIRS

Двухфазное течение иммунных нарушений при сепсисе Далее в организме закономерно включаются компенсаторные механизмы, формирующие гиповоспалительное состояние. В R.C. Bone 1996 г. предложил использовать термин CARS, или синдром компенсаторного противовоспалительного ответа – «Compensatory Antiinflammatory Response Syndrome».

хронизацией или диссеминацией инфекции нарушением процесса репарации утяжелением эндотоксикоза формированием поздней полиорганной недостаточности Клинически это проявляется:

КЛАССИФИКАЦИЯ (продолжение) СЕПСИС – синдром системной воспалительной реакции на инвазию микроорганизмов. Характеризуется наличием явного или предполагаемого очага инфекции и двух или более признаков синдрома системного воспалительного ответа
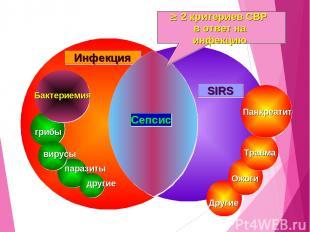
SIRS Панкреатит Травма Ожоги Другие паразиты другие грибы вирусы Бактериемия Инфекция Сепсис 2 критериев СВР в ответ на инфекцию

КЛАССИФИКАЦИЯ (продолжение) ТЯЖЕЛЫЙ СЕПСИС – сепсис, сочетающийся с органной дисфункцией (нарушение функции органов, при котором их нормальная физиологическая работа не может осуществляться без дополнительных поддерживающих мероприятий), гипотензией, нарушением тканевой перфузии

КЛАССИФИКАЦИЯ (продолжение) СЕПТИЧЕСКИЙ ШОК – тяжелый сепсис с признаками тканевой и органной гипоперфузии и рефрактерной артериальной гипотензией (снижение сист. АД < 90 мм рт.ст. у нормотоников или более, чем на 40 мм рт.ст. от привычного АД у лиц с артериальной гипертонией), не устраняющейся с помощью объемного возмещения и требующей включения в программу лечения симпатомиметиков

ЭТИОЛОГИЯ

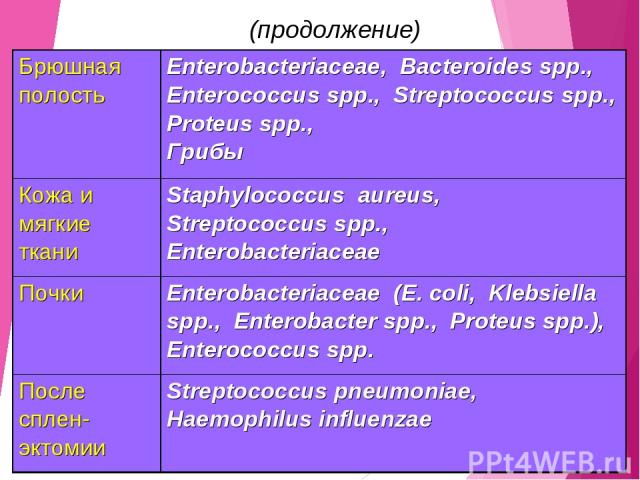
Существует определенная взаимосвязь между локализацией первичного очага инфекции и характером микрофлоры Локализация первичного очага Наиболее вероятные возбудители Легкие (НП, развившаяся вне ОРИТ) Streptococcus pneumoniae, Enterobacteriaceae, Staphylococcus aureus (в том числе MRSA) Легкие (НП, развившаяся в ОРИТ) Pseudomonas aeruginosae, Enterobacteriaceae (Klebsiella spp., Klebsiella pneumoniae, Escherichia coli), Acinetobacter spp., Staphylococcus aureus (в том числе MRSA)
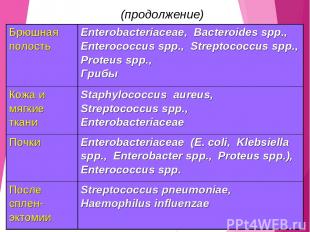
(продолжение) Брюшная полость Enterobacteriaceae, Bacteroides spp., Enterococcus spp., Streptococcus spp., Proteus spp., Грибы Кожа и мягкие ткани Staphylococcus aureus, Streptococcus spp., Enterobacteriaceae Почки Enterobacteriaceae (E. coli, Klebsiella spp., Enterobacter spp., Proteus spp.), Enterococcus spp. После сплен-эктомии Streptococcus pneumoniae, Haemophilus influenzae
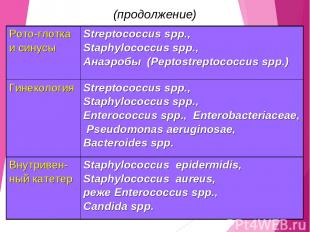
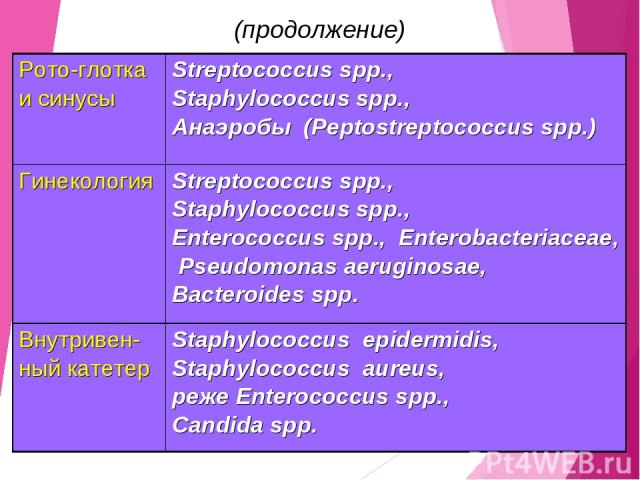
(продолжение) Рото-глотка и синусы Streptococcus spp., Staphylococcus spp., Анаэробы (Peptostreptococcus spp.) Гинекология Streptococcus spp., Staphylococcus spp., Enterococcus spp., Enterobacteriaceae, Pseudomonas aeruginosae, Bacteroides spp. Внутривен-ный катетер Staphylococcus epidermidis, Staphylococcus aureus, реже Enterococcus spp., Candida spp.

НАИБОЛЕЕ РАСПРОСТРАНЕННЫЕ ВОЗБУДИТЕЛИ ПОСЛЕОПЕРАЦИОННЫХ РАНЕВЫХ ИНФЕКЦИЙ Staphylococcus aureus Коагулазо-негативные стафилококки: S. epidermidis и др.

(продолжение) Bacteroides fragilis

Морфология первичного очага в определенной степени зависит от вида и свойств возбудителя Для стафилококковой инфекции типично гнойное воспаление с образованием абсцессов, чаще в мягких тканях (жировая клетчатка, скелетные мышцы) При стрептококковой инфекции более выражены некротические изменения Синегнойные палочки интенсивно размножаются в некротизированных стенках разрушенных сосудов и в некротических массах.

Частота грам (+) и грам (–) сепсиса приблизительно равна. Выросла частота сепсиса, вызванного неферментирующими грам (–) бактериями. Увеличилась доля инфекций, вызванных условно-патогенными микроорганизмами. Появились прежде редко встречающиеся микробы, грибы различных видов.

ОСНОВНЫЕ ВОЗБУДИТЕЛИ ПРИ СЕПСИСЕ Грам (+): St. aureus, St. epidermidis, Enterococcus spp., Str. pneumoniae Грам (-): E. coli; неферментирующие Грам (-) бактерии: Pseudomonas spp. (Ps. aeruginosae), Acinetobacter spp., Klebsiella spp. (Klebsiella pneumoniae – продуцент бета-лактамаз расширенного спектра БЛРС), Enterobacter cloacae.

Хит-парад самых опасных патогенов 5 самых опасных патогенов по версии ASID (Американское Общество Инфекционных Болезней) MRSA Acinetobacter baumannii P. aeruginosa E. faecium Aspergillus MRSA E. faecium

ГРАМПОЛОЖИТЕЛЬНЫЕ БАКТЕРИИ: Сегодня повсеместно регистрируется рост тяжелых госпитальных инфекций, вызванных грамположительными микроорганизмами – стафилококками и энтерококками – как это было до широкого внедрения антибиотиков в клиническую практику

СОВРЕМЕННЫЙ ФЕНОМЕН АГРЕССИВНОСТИ ГРАМПОЛОЖИТЕЛЬНЫХ БАКТЕРИЙ ОБУСЛОВЛЕН: Широким внедрением в клиническую практику инвазивных вмешательств, нарушающих целостность кожи и слизистых Применением внутрисосудистых устройств – периферических и центральных внутривенных систем, катетеров, приспособлений для мониторинга кровяного давления Применением мочевых катетеров, трахеостомических трубок, назогастральных зондов, перитонеальных катетеров, различных дренажных трубок

(продолжение) Интенсивным использованием антибиотиков широкого спектра действия с лечебной и профилактической целью, высокоактивных в отношении грамотрицательной флоры (цефалоспорины III поколения, карбапенемы) Применением иммунодепрессантов, а также увеличением количества пациентов с иммунодефицитными состояниями Длительным парентеральным питанием В неонаталогии – увеличением выживаемости недоношенных новорожденных.

Факторы, влияющие на частоту инфекций, вызванных MRSA Длительность госпитализации (>14 дней) Предшествующая антибиотикотерапия Хирургические вмешательства Нахождение в отделении реанимации/ожоговом отделении Контакт с больным, инфицированным MRSA

Факторы риска: ИВЛ, нозокомиальная пневмония, поздняя ВАП респираторные инфекции, сепсис, инфекции мочевыводящих путей, антибиотики широкого спектра, гормоны, нейтропения. Палочка сине-зеленого гноя – вирулентный и устойчивый микроб. Паразитирует на коже человека и на разных влажных поверхностях.

Клиническое значение Acinetobacter spp. Вызывает тяжелые инфекции в ОРИТ Быстрое формирование полирезистентности в процессе лечения Эффективность антибиотиков мало предсказуема.

Факторы риска: - применение антибиотиков широкого спектра действия (карбапенемов, цефалоспоринов IV) - иммунодефицит - сахарный диабет - длительные/повторные госпитализации - наличие инвазивных устройств (постоянных внутривенных, мочевых катетеров и др.) - проведение химиотерапии - больные на перитонеальном диализе грамотрицательный аэробный микроорганизм разрушает все беталактамные антибиотики, включая карбапенемы и цефалоспорины IV, за счет выработки металлозависимых беталактамаз Stenotrophomonas maltophilia

Впервые был обнаружен около 25 лет назад. 99% бактерий существуют в природных экосистемах не ввиде свободно плавающих клеток, а специфически организованных, прикрепленных к субстрату биопленок. ФЕНОМЕН «СОЦИАЛЬНОГО ПОВЕДЕНИЯ БАКТЕРИЙ» ИЛИ «ЧУВСТВО КВОРУМА»

Staphylococcus spp. Streptococcus spp. Haemophilus influenzae Мoraxella catharralis Pseudomonas aeruginosa Наиболее известные микроорганизмы, образующие биопленки

Выявление клинических проявлений инфекции и поиски очага инфекции Идентификация типа возбудителя Использование антибактериального препарата, действующего на данный тип возбудителя ЗАДАЧИ, СТОЯЩИЕ ПЕРЕД ВРАЧОМ

Выявление клинических проявлений инфекции и поиски очага инфекции ЗАДАЧИ, СТОЯЩИЕ ПЕРЕД ВРАЧОМ

ОСНОВЫВАЕТСЯ НА СЛЕДУЮЩИХ ПРИЗНАКАХ Клинические проявления инфекции Наличие SIRS Лабораторные маркеры системного воспаления (повышение в крови уровня прокальцитонина, С-реактивного протеина, а также интерлейкинов-1, 6, 8, 10 и фактора некроза опухоли) Выделение возбудителя ДИАГНОСТИКА СЕПСИСА

Другие причины лихорадки: нормальная реакция организма на операционную травму посттрансфузионные реакции и реакции на введение лекарственных средств наличие гематомы воспаление после введения растворов или лекарств, обладающих раздражающим действием Повышение температуры тела у оперированных пациентов не всегда является признаком развития инфекционного осложнения.

Маркер системной воспалительной реакции и бактериального инфицирования. Чувствительный тест, позволяет обнаружить низкие концентрации ПКТ и распознать клинически значимую бактериальную инфекцию на самых ранних стадиях Прокальцитониновый тест (РСТ)
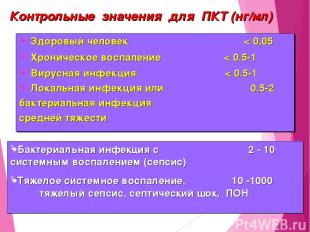
Контрольные значения для ПКТ (нг/мл) Здоровый человек < 0,05 Хроническое воспаление < 0.5-1 Вирусная инфекция < 0.5-1 Локальная инфекция или 0.5-2 бактериальная инфекция средней тяжести Бактериальная инфекция с 2 - 10 системным воспалением (сепсис) Тяжелое системное воспаление, 10 -1000 тяжелый сепсис, септический шок, ПОН

Идентификация типа возбудителя ЗАДАЧИ, СТОЯЩИЕ ПЕРЕД ВРАЧОМ


Микробиологическое обследование Ориентировочный экспресс-метод – микроскопия препаратов мазка секрета нижних дыхательных путей, нативно окрашенного по Граму. Количественный метод – посев крови, бронхиального секрета, плевральной жидкости, пунктата инфильтрата или абсцесса, биопсия тканей. Серологические методы – выявление специфических антител и антигенов в сыворотке крови.

Проводится у всех пациентов с подозрением на гнойно-септическими осложнениями. Выделение гемокультуры является наиболее информативным показателем этиологии бактериальной инфекции, однако результативность посевов крови не превышает 10%. КУЛЬТУРАЛЬНОЕ ИССЛЕДОВАНИЕ КРОВИ

Кровь для исследования необходимо забирать до назначения антибиотиков. На фоне введения антибиотиков забор крови следует выполнять непосредственно перед очередным введением препарата. Необходимым минимумом забора являются 2 пробы, взятые из вен разных верхних конечностей с интервалом 30 минут. ПРАВИЛА ЗАБОРА КРОВИ

Не имеет смысла забор крови на высоте лихорадки, т.к. это не повышает чувствительности метода. Кровь для исследования необходимо забирать только из периферической вены. Оптимальным является использование стандартных коммерческих флаконов с готовыми питательными средами, а не флаконов с питательными средами, закрытых ватно-марлевыми пробками, приготовленными в лаборатории. (продолжение)

Забор крови из периферической вены следует проводить с тщательным соблюдением асептики. Венепункцию выполняют в стерильных перчатках. Для каждой пробы забирают 10 мл крови. (продолжение)

ПРИНЦИПИАЛЬНЫЕ ПОЛОЖЕНИЯ ЛЕЧЕНИЯ СЕПСИСА ПОЛНОЦЕННАЯ ХИРУРГИЧЕСКАЯ САНАЦИЯ ОЧАГА ИНФЕКЦИИ ЭФФЕКТИВНАЯ ИНТЕНСИВНАЯ ТЕРАПИЯ АДЕКВАТНАЯ АНТИМИКРОБНАЯ ТЕРАПИЯ
Дренирование гнойных полостей Удаление очагов инфицированного некроза Удаление внутренних источников контаминации ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ СЕПСИСА

Использование антибактериального препарата, действующего на данный тип возбудителя ЗАДАЧИ, СТОЯЩИЕ ПЕРЕД ВРАЧОМ

ПРИНЦИПЫ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ ПРИ СЕПСИСЕ

Есть ли клинические показания для назначения антибиотиков? Взят ли материал для бактериологического посева? Какой наиболее вероятный возбудитель? Какие особенности пациента необходимо учитывать? Какой наилучший путь введения? Какая доза и кратность введения? Предполагаемая длительность лечения? Какие предполагаются методы контроля за эффективностью и безопасностью терапии? Какой из доступных антибиотиков является наилучшим для данного пациента? При назначении антибиотикотерапии врачу необходимо обратить внимание на следующие моменты и ответить на вопросы:
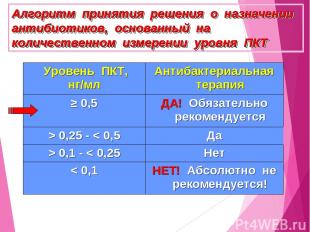
Алгоритм принятия решения о назначении антибиотиков, основанный на количественном измерении уровня ПКТ Уровень ПКТ, нг/мл Антибактериальная терапия ≥ 0,5 ДА! Обязательно рекомендуется > 0,25 - < 0,5 Да > 0,1 - < 0,25 Нет < 0,1 НЕТ! Абсолютно не рекомендуется!

Антибактериальная терапия: Эмпирическая Этионаправленная Комбинированная Ступенчатая Эскалационная Де-эскалационная Оригинальным препаратом или дженериком

ВЫБОР ОПТИМАЛЬНОГО РЕЖИМА АДЕКВАТНОЙ СТАРТОВОЙ АБТ ОСНОВЫВАЕТСЯ НА: Прогнозировании этиологии инфекционного процесса на основе микробного мониторинга Анализе микробного пейзажа в конкретной клинике Информации о чувствительности микроорганизмов, выделенных в данном стационаре в последние годы

(продолжение) Данных антибиотикограммы Клинических данных, подтверждающих эффективность именно данного препарата или комбинации препаратов для лечения тяжелых инфекций Предполагаемой резистентности возбудителей

Адекватная стартовая АБТ повышает выживаемость у пациентов с гнойно-септическими осложнениями в сочетании с ПОН и уменьшает длительность пребывания в стационаре у лиц с гнойно-септическими осложнениями без органно-системной недостаточности

Адекватная эмпирическая антибактериальная терапия У пациентов, получающих неадекватную АБТ: Летальность увеличивалась в 5,5 раз Продолжительность койко-дня – в 2 раза

АНТИБАКТЕРИАЛЬНАЯ ТЕРАПИЯ ЭСКАЛАЦИЯ Традиционный терапевтический подход – характеризуется назначением антибиотика одного типа (например, цефалоспорина II поколения) После получения микробиологических данных, свидетельствующих о резистентности возбудителей к первоначально назначенному препарату или в случае ухудшения клинической картины переход к препаратам с более широким спектром активности (например, имипенему, фторхинолонам)

ДЕ-ЭСКАЛАЦИЯ Эмперическое стартовое использование антибиотиков широкого спектра активности, что дает высокую вероятность охвата наиболее вероятных патогеных возбудителей Последующий (от 48 до 72 часов) переход на а/б узконаправленного спектра действия на основе полученных микробиологических данных и клинического течения для более конкретного охвата патогенного возбудителя, предотвращения развития резистентности и снижения затрат на лечение

Показания для проведения де-эскалационной терапии Высокий риск инфекций, вызванных полирезистентными возбудителями (Pseudomonas aeruginosa и Acinetobacter spp., K. Pneumoniae). Высокий риск неблагоприятного исхода (шок, полиорганная недостаточность). Отсутствие локальных данных по чувствительности возбудителей нозокомиальной инфекции.

Правило четырех “D” Оптимальный препарат ( Drug) Адекватная Доза Целенаправленная Де-эскалация Рациональная Длительность Joseph J, Rodvold KA. Expert Opin Pharmacother. 2008;9(4):561-575.

Антиинфекционные средства Антисептики Дезинфектанты Антимикробные препараты антибактериальные противогрибковые противовирусные антипаразитарные

Антибактериальные препараты Антибиотики Вещества биологического происхождения или продукты их химической модификации Химиопрепараты Вещества не встречающиеся в живой природе

По спектру действия По механизму действия бактерицидные бактериостатические По происхождению По точке приложения По фармакодинамике По химической структуре Принципы классификации антимикробных препаратов

Бактерицидное действие Необходимо для лечения тяжелых инфекций сепсиса эндокардита хронических инфекционных болезней у лиц с подавленным иммунитетом Бактериостатическое действие Как правило является достаточным для борьбы с нетяжелой острой инфекцией, т.к. макроорганизм сам в состоянии справиться с оставшимися микробами

Виды антимикробных препаратов Бактерицидное действие бета-лактамные антибиотики аминогликозиды полимиксины фторхинолоны ко-тримоксазол Бактериостатическое действие тетрациклины макролиды хлорамфеникол рифампицин

Классификация антимикробных препаратов Бета-лактамные антибиотики Макролиды Тетрациклины Аминогликозиды Нитрофураны, фторхинолоны, производные 8-оксихинолина Гликопептиды, линкозамиды Оксазолидины Сульфаниламиды и комбинированные препараты

«Магическая пуля» - P. Ehrlich, 1900-е Препарат 606 для лечения сифилиса Открытие пенициллина A. Fleming – 1929 Разработка лекарственного препарата Florey & Chaini – 1940-e Синтез пронтозила G. Domagk – 1935 ЭТАПЫ РАЗВИТИЯ

Пенициллины Стрептококковые инфекции (тонзиллофарингит, скарлатина, рожа ± инфекционный эндокардит, ИКиМТ) Стафилококковые инфекции (инфекции костей и суставов, инфекционный эндокардит (MSSA) Внебольничные легкие и неосложненные инфекции верхних и нижних дыхательных путей, ИМП + энтерококковые инфекции Менингококковые инфекции Клостридиальные инфекции (газовая гангрена) Сифилис Лептоспироз Актиномикоз

Цефалоспорины I поколение - Цефазолин II поколение - Цефуроксим III поколение - Цефотаксим, цефтриаксон - Цефтазидим, цефоперазон - Цефепим
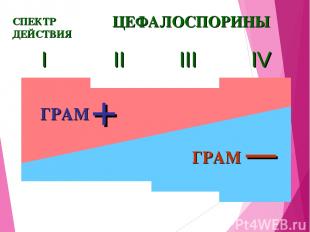
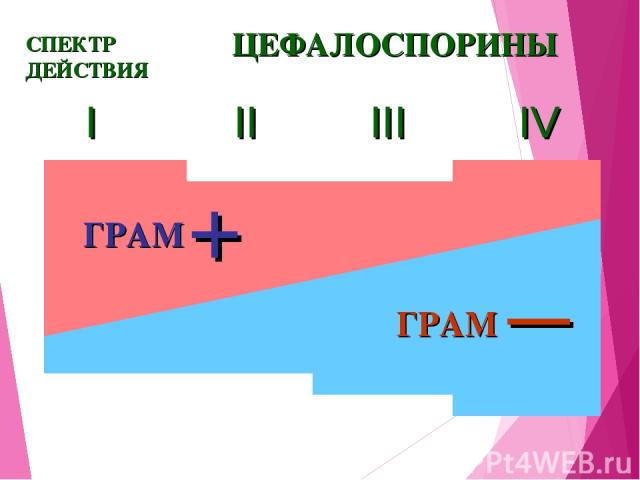
I II III IV ЦЕФАЛОСПОРИНЫ СПЕКТР ДЕЙСТВИЯ ГРАМ — + ГРАМ

Показания для применения цефалоспоринов I - II поколения Периоперационная профилактика в хирургии Цефазолин - Staphylococci (MSSA) Доказанные или предполагаемые стафилококковые инфекции при невысоком риске MRSA (эндокардит, мастит, инфекции кожи и мягких тканей, костей и суставов) Цефуроксим +Haemophilus influenzae Нетяжелые внебольничные инфекции кожи и мягких тканей, дыхательных и мочевыводящих путей Не назначать при госпитальных инфекциях !

Цефалоспорины III поколения Цефотаксим Цефтриаксон Высокая активность против пневмококков и Грам(-) Тяжелые внебольничные инфекции различной локализации + Сальмонеллезы, ИКБ Не применять при госпитальных инфекциях! Цефтазидим Цефоперазон Высокая активность против P.aeruginosa и Грам(-) Тяжелые госпитальные инфекции различной локализации при подтвержденной или вероятной этиологической роли P.aeruginosa Фебрильная нейтропения

Цефалоспорины IV поколения Цефепим В отношении Гр (+) сходен с цефалоспоринами I – II В отношении Гр (-) сходен с цефалоспоринами III Сохраняет эффективность против некоторых резистентных к ЦС III энтеробактерий Активен против P.aeruginosa (= цефтазидиму)

Пробелы в спектре активности цефалоспоринов Энтерококки MRSA Хламидии, микоплазмы, уреаплазмы, легионеллы Листерии Инфекции, вызванные продуцентами БЛРС

ЗАЩИЩЕННЫЕ БЕТА-ЛАКТАМЫ Спектр природной активности определяется основным антибиотиком Ингибиторы уменьшают степень приобретенной резистентности, связанной с продукцией бета-лактамаз Ингибиторы не предохраняют антибиотик от резистентности, связанной с другими механизмами

ИНГИБИТОРЫ БЕТА-ЛАКТАМАЗ Амоксициллин / клавуланат Амоксициллин / сульбактам Ампициллин / сульбактам Внебольничные инфекции различной локализации + интраабдоминальные инфекции, периоперационная профилактика в хирургии Антипсевдомонадные пенициллины: Пиперациллин / тазобактам Цефоперазон / сульбактам Нозокомиальные инфекции различной локализации, интраабдоминальные инфекции Клавулановая кислота Сульбактам Тазобактам

ПИПЕРАЦИЛЛИН Уреидопенициллин (полусинтетический пенициллин) Бактерицидное действие Обладает расширенным спектром действия: активен в отношении многих Грам(+) и Грам(-) аэробных и анаэробных возбудителей Высокий потенциaл в отношении P. aeruginosa Менее активен или совсем неактивен в отношении возбудителей, продуцирующих β-лактамазы

ТАЗОБАКТАМ Мощный ингибитор многих β-лактамаз Обладает относительно низкой антимикробной активностью

ПОКАЗАНИЯ К ПРИМЕНЕНИЮ Взрослые и дети старше 12 лет: Инфекции нижних дыхательных путей Инфекции мочевыводящих путей (осложненные и неосложненные) Интраабдоминальные инфекции Инфекции кожи и мягких тканей Септицемия Гинекологические инфекции

ПОКАЗАНИЯ К ПРИМЕНЕНИЮ Бактериальная инфекция у больных с нейтропенией (в комбинации с аминогликозидами) Инфекции костей и суставов Смешанные инфекции, вызванные грам(+)/грам(-) аэробными и анаэробными микроорганизмами. Дети в возрасте от 2 до 12 лет: Интраабдоминальные инфекции Инфекции на фоне нейтропении (в комбинации с аминогликозидами).

ПРОТИВОПОКАЗАНИЯ Повышенная чувствительность к β-лактамным препаратам или к ингибиторам β-лактамаз Детский возраст до 2 лет С ОСТОРОЖНОСТЬЮ Тяжелые кровотечения Псевдомембранозный колит Тяжелая почечная недостаточность

ДОЗИРОВКА В/в струйно или капельно Взрослым и детям старше 12 лет: 4,5 г (4 г пиперациллина + 0,5 г тазобактама) Х 3-4 раза в день Детям 2-12 лет: Фебрильная нейтропения 90 мг/кг каждые 6 часов

Цефоперазон / сульбактам Расширение клинической активности цефоперазона на штаммы Грам(-) бактерий, продуцирующих БЛРС и устойчивых к незащищенным цефалоспоринам III Возможность применения при госпитальных инфекциях, вызванных P. aeruginosa, Acinetobacter Проявление клинической активности против анаэробов Возможность применения в режиме монотерапии при смешанных инфекциях (интраабдоминальные, гинекологические, раневые инфекции)

Acinetobacter spp. Наиболее надежный режим терапии – карбапенемы и комбинация сульбактама с бета-лактамами

Карбапенемы Наиболее широкий спектр среди всех бета-лактамных антибиотиков (кроме MRSA, E.faecium, S.maltophilia, внутриклеточных микроорганизмов) Сохраняют активность в отношении микробов, резистентных к пенициллинам, цефалоспоринам III-IV, фторхинолонам Нет существенного увеличения устойчивости Грам(-) бактерий (кроме P.aeruginosa)

Карбапенемы: Имипенем/циластатин >грам(+) Меропенем > грам (-) Дорипенем = Меропенем Эртапенем – всё кроме Acinetobacter и P.aeruginosa

Карбапенемы Имипенем более активен против энтерококков и стафилококков Клинического значения не имеет Режим дозирования: 0,5-1 г в 3-4 введения Меропенем более активен в отношении P. aeruginosa и Burkholderia cepacia Клинически значимое преимущество Особые показания: Менингит P. aeruginosa Режим дозирования: 1 г в 3-4 введения

Карбапенемы: эртапенем Не антипсевдомонадный карбапенем P. aeruginosa и Acinetobacter природно устойчивы Активность против Грам(+), Enterobacteriaceae и анаэробов сходна с имипенемом Позиционирование: Тяжелые внебольничные и ранние послеоперационные нозокомиальные инфекции вызванные Enterobacteriaceae - продуцентами БЛРС Режим дозирования: 1 г 1 раз в сутки

Карбапенемы: устойчивые микроорганизмы Staphylococcus spp., устойчивые к оксациллину Enterococcus faecium Stenotrophomonas maltophilia

Аминогликозиды Природная активность Высокая: Грам(-) бактерии Умеренная: стафилококки Слабая: энтерококки Природно устойчивы: Стрептококки, пневмококки, анаэробы Активность in vitro при отсутствии клинической эффективности: haemophilus spp., legionella spp., shigella spp., salmonella spp. I поколение – стрептомицин, неомицин, канамицин II - гентамицин, тобрамицин, нетилмицин III - амикацин

Аминогликозиды Резистентность Грам(-) бактерий : гентамицин > нетилмицин > амикацин Гентамицин Стафилококковые инфекции (в комбинации с оксациллином или ванкомицином) Энтерококковые инфекции (в комбинации с ампициллином или ванкомицином) Амикацин Инфекции, вызванные P. aeruginosa ( в комбинации с антисинегнойными бета-лактамами) Нетилмицин (при ХПН, слуховых и вестибулярных расстройствах)

Требования к режиму дозирования аминогликозидов стремление к достижению максимальных концентраций в пределах терапевтического диапазона при достаточно длительных интервалах между введениями Оптимальным является болюсное введение всей суточной дозы однократно внутривенно в виде короткой инфузии: Амикацин 10 - 15 мг/кг/сут Гентамицин 3 - 5 мг/кг/сут Нетилмицин 4 - 6 мг/кг/сут О днократное введение всей суточной дозы АГ не менее эффективно и более безопасно, чем многократное введение!

Фторхинолоны Ранние Преим. Гр(-) Ципрофлоксацин + синегнойная палочка + стафилококк Офлоксацин +стафилококк Пефлоксацин (менингит, ИЖВП, ХПН) Кишечные инфекции + ИМП + госпитальные инфекции Новые Гр (-), Гр (+) Левофлоксацин + стрептококк Моксифлоксацин + стрептококк, анаэробы Тяжелые внебольничные инфекции различной локализации
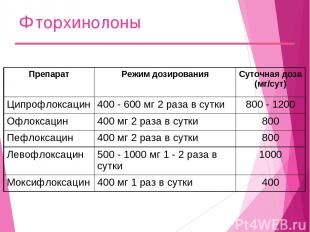
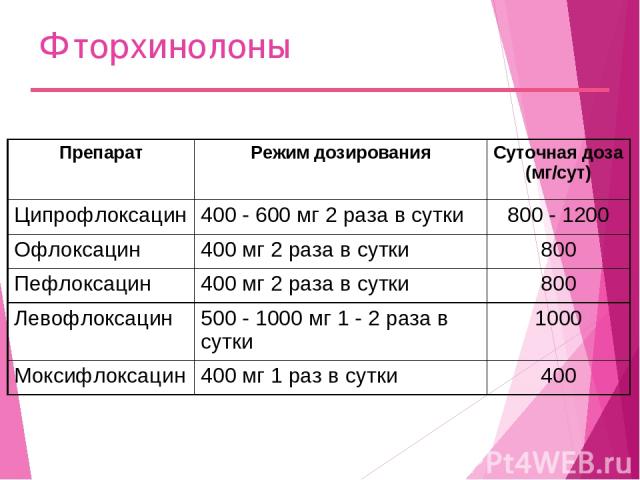
Фторхинолоны Препарат Режим дозирования Суточная доза (мг/сут) Ципрофлоксацин 400 - 600 мг 2 раза в сутки 800 - 1200 Офлоксацин 400 мг 2 раза в сутки 800 Пефлоксацин 400 мг 2 раза в сутки 800 Левофлоксацин 500 - 1000 мг 1 - 2 раза в сутки 1000 Моксифлоксацин 400 мг 1 раз в сутки 400

Гликопептиды Ванкомицин Спектр активности: резистентные Гр (+) MRSA, ARE анаэробы (+ Clostridium difficile) Режим дозирования: 30-40 мг/кг/сут, не более 2 г/сут через 12 часов, продолжительность введения не менее 1 часа.

Побочные эффекты ванкомицина Гипотония Анафилаксия Псевдомембранозный колит Кожные реакции Лекарственная лихорадка Флебиты Нефротоксичность Ототоксичность Red-neck / red-man syndrome (синдром красной шеи ) Обусловлен выбросом гистамина при быстром введении ванкомицина. Не является показанием для отмены препарата.
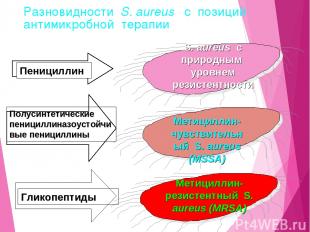
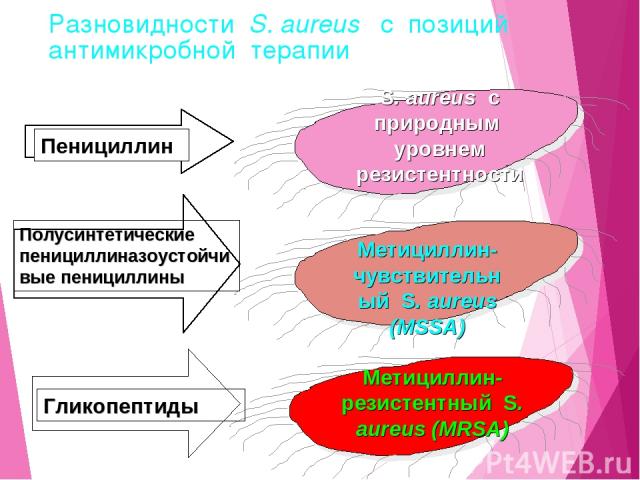
Разновидности S. aureus с позиций антимикробной терапии

При высокой вероятности стафилококковой или энтерококковой инфекции или при обоснованном подозрении на MRSA использование гликопептидов: ванкомицина (эдицина), линезолида (зивокса) или даптомицина (кубицина).

ДАПТОМИЦИН (CUBICIN) Даптомицин является первым представителем нового класса антибиотиков – циклических липопептидов. Он обладает бактерицидным действием в отношении широкого спектра грамположительных возбудителей, включая резистентные к другим препаратам штаммы. Применение даптомицина (4 мг/кг 1 раз в сутки внутривенно) одобрено для лечения осложненных инфекций кожи и ее придаточного аппарата, вызванных чувствительной к препарату грамположительной флорой.

Оксазолидиноны Линезолид Спектр активности: резистентные Гр (+) в том числе и к Ванкомицину (MRSA, VISA, VRE) анаэробы (кроме Clostridium difficile) Отличия: Отсутствует перекрестная резистентность с антибиотиками других групп Обладает лучшей фармакокинетикой и переносимостью Биодоступность - 100% Эффективно проникает в ткани Режим дозирования: 600 мг (в/в или внутрь) через 12 ч

Макролиды Streptococcus Активность высокая Устойчивость умеренная, но выше чем у пенициллина Различия между препаратами минимальны и клинически не значимы Chlamydia, Mycoplasma Активность высокая Различия между препаратами минимальны и клинически не значимы Резистентность не документирована Staphylococcus MS при непереносимости бета-лактамов Haemophilus influenzae Активность низкая, вероятность достижения эффекта незначительна

Современные макролиды Побочные (негативные) эффекты макролидов Стимуляция моторики ЖКТ Гепатит, холестаз (эритромицин) Тромбофлебит при в/в введении Лекарственные взаимодействия Побочные (позитивные) эффекты воздействие на биопленки (блокада“Quorum sensing”) противовоспалительное муколитическое Азитромицин, кларитромицин, джозамицин, спирамицин и др. Спектр эритро Резистентность эритро Стабильность > эритро Биодоступность > эритро Комплаентность > эритро Безопасность > эритро

Клиническое применение макролидов Тяжелая внебольничная пневмония в комбинации с бета-лактамами (Ц II - III, АКК) Эритромицин или Кларитромицин или Азитромицин или Спирамицин Урогенитальный хламидиоз и микоплазмоз Легионеллез Эрадикация H.pylori (Клар) Токсоплазмоз (Спир, Клар, Рокс, Азитро) Периодонтит (Спирамицин) Профилактика эндокардита (при непереносимости пенициллинов) Дифтерия, коклюш

КЛАРИТРОМИЦИН (КЛАЦИД) Кларитромицин не только разрушает матрикс биопленок, образованных P.aeruginosa, но и снижает ее двигательную активность. В итоге это приводит к снижению вирулентности и существенному повышению эффективности специфических антисинегнойных препаратов.

Назначение кларитромицина при «позднем» уросепсисе синегнойной этиологии увеличивает выживаемость и улучшает клинические показатели, что по-видимому связано с иммуномодулирующим действием препарата, реализующимся через взаимодействие с моноцитами.

Линкозамиды Клиндамицин превосходит Линкомицин по уровню антибактериальной активности и биодоступности Спектр активности: Грам(+) (кроме MRSA и энтерококков), анаэробы (устойчивость Bacteroides spp. 15-30%) Показания: Нетяжелые стафилококковые и стрептококковые инфекции Некротизирующие инфекции мягких тканей Инфекции костей и суставов В сочетании с бета-лактамами при абдоминальных инфекциях и легочных нагноениях (эмпиема, абсцесс)

Тетрациклины Доксициклин превосходит Тетрациклин по биодоступности, длительности действия и переносимости Современное применение ограничено ростом устойчивости микроорганизмов Препараты выбора при хламидийных и микоплазменных инфекциях В сочетании с бета-лактамами при эмпирической терапии воспалительных заболеваний органов малого таза ИКБ

Имидазолы (метронидазол и др.) Спектр активности Анаэробы Helicobacter pylori Простейшие Показания Анаэробная инфекция предполагаемая или подтвержденная: Периоперационная профилактика в абдоминальной хирургии Интраабдоминальные и инфекции органов малого таза Инфекции НДП (аспирац. пневмония, эмпиема плевры, абсцесс легкого) Инфекции ЦНС (менингит, абсцесс мозга) Инфекции полости рта Псевдомембранозный колит

Монобактамы - Азтреонам Полимиксины – Полимиксин В, Полимиксин М Сульфаниламиды – Ко-тримоксазол (Бисептол) Нитрофураны – Фурагин, Фуразолидон, Фурамаг Хлорамфеникол (Левомицетин) Рифампицин Мупироцин (Бактробан) ПРЕПАРАТЫ РАЗНЫХ ГРУПП Фосфомицин
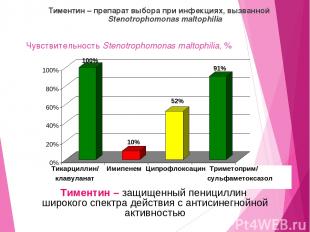
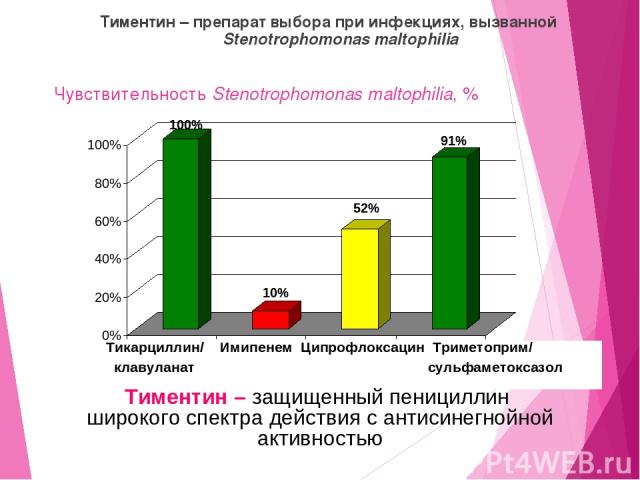
Чувствительность Stenotrophomonas maltophilia, % Тиментин – препарат выбора при инфекциях, вызванной Stenotrophomonas maltophilia Тикарциллин/ Имипенем Ципрофлоксацин Триметоприм/ клавуланат сульфаметоксазол Тиментин – защищенный пенициллин широкого спектра действия с антисинегнойной активностью

При неэффективности предшествующей терапии, включавшей гликопептиды – противогрибковые препараты амфотерицин В, флюконазол (дифлюкан), каспофунгин (кансидас) ,

ОСОБЕННОСТИ АБТ У ДЕТЕЙ Физиологические особенности детского организма приводят к изменению фармакокинетики лекарственных средств. Использование некоторых из них запрещено или ограничено в связи с риском тяжелых нежелательных реакций

Стартовая антимикробная терапия сепсиса

Стартовая антибактериальная терапия сепсиса с неустановленным первичным очагом Условия проникновения Средства 1-го ряда Альтернативные средства Сепсис, развившийся во внебольничных условиях Амоксициллин/клавуланат +/- аминогликозид Ампициллин/сульбактам +/- аминогликозид Цефалоспорин III поколения (лендацин, клафоран) +/- метронидазол Сепсис, развившийся в условиях стационара, АРАСНЕ < 15, без ПОН Цефепим +/- метронидазол Цефоперазон/сульбактам Имипенем/целастатинмеропенем Цефтазидим +/- метронидазол Ципрофлоксацин +/- метронидазол Сепсис, развившийся в условиях стационара, АРАСНЕ > 15, и/или ПОН Имипенем/целастатин, меропенем дорипенем Цефепим +/- метронидазол Цефоперазон/сульбактам Ципрофлоксацин +/- метронидазол

Периоперационная АБП “Периоперационная профилактика – это назначение антибактериального препарата пациентам без признаков инфекционного процесса с целью предотвращения развития постоперационных инфекционных осложнений.” Периоперационная профилактика позволяет избежать развития: Хирургических раневых инфекций Абсцессов Сепсиса Инфекций сосудов Инфекций мочевыводящих путей Инфекций дыхательных путей

ПЕРИОПЕРАЦИОННАЯ АБП Стандарт оказания медицинской помощи при многих хирургических вмешательствах «Очень короткий курс» введения антибиотиков –начинается непосредственно перед операцией и продолжается не более 24 часов после операции Антибиотик должен быть введен до первого хирургического разреза, чтобы обеспечить присутствие препарата в оптимальной концентрации в тех тканях, где произведен этот разрез Обычно используется одна полная терапевтическая доза антибиотика Антибиотикопрофилактика не является попыткой «стерилизовать» ткани

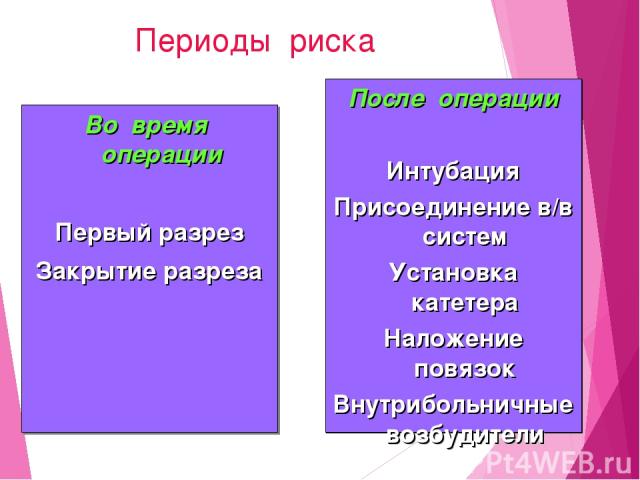
Периоды риска Во время операции Первый разрез Закрытие разреза После операции Интубация Присоединение в/в систем Установка катетера Наложение повязок Внутрибольничные возбудители

АНТИБИОТИКИ «ЗОЛОТОГО СТАНДАРТА» ДЛЯ ПЕРИОПЕРАЦИОННОЙ АНТИБИОТИКОПРОФИЛАКТИКИ Амоксиклав® (амоксициллин/клавуланат) Цефазолин Цефуроксим

Местное применение системных антибиотиков (обкалывание раны, введение в дренажные трубки, орошение полостей во время операции) с целью профилактики ИОХВ не допускается - эффективность такого пути введения мала и способствует развитию антибиотикорезистентности у микроорганизмов. Комбинация местного и системного применения антибиотиков не превосходит по эффективности режим ПАП, когда антибиотик вводится только системно.

Антибиотикопрофилактика, как правило, неэффективна и, следовательно, нецелесообразна в тех клинических ситуациях, когда у пациентов сохраняются условия для длительной контаминации тканей в послеоперационном периоде, а именно: - трахеостома или интубация (не позволяет предотвратить развитие инфекций нижних дыхательных путей) - постоянный мочевой катетер - центральный сосудистый катетер - дренаж плевральной и/или брюшной полости - открытые раны, в том числе и ожоговые (у большинства пациентов)

Выбор дозы, методики введения препарата зависят от типа бактерицидности, наличия постантибиотического эффекта. Использовать внутривенный путь введения антимикробных средств. Рационально использовать продленную инфузию, а не болюсное введение. Продолжительность при инфекциях, вызванных чувствительными организмами – 7-10 дней. При инфекциях, вызванных мультирезистентными организмами – 14-21 день. РЕКОМЕНДАЦИИ ПО АБТ
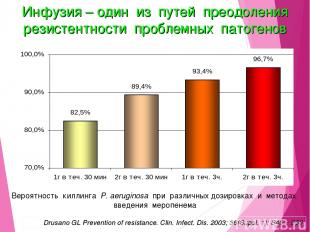
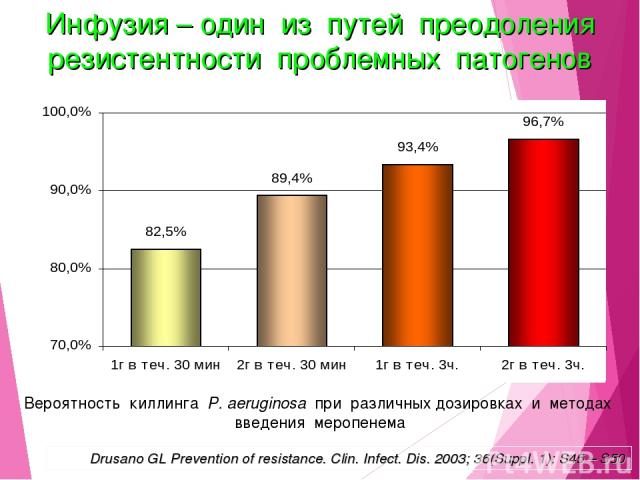
Вероятность киллинга P. aeruginosa при различных дозировках и методах введения меропенема Drusano GL Prevention of resistance. Clin. Infect. Dis. 2003; 36(Suppl. 1): S45 – S50 Инфузия – один из путей преодоления резистентности проблемных патогенов

Причины неэффективности АБТ Несанированный очаг хирургической инфекции Тяжесть состояния больного Позднее начало адекватной АБТ Недостаточная биодоступность препаратов (плохая пенетрация в органы) Несоблюдение режима дозирования препаратов (способ введения, разовая доза, интервал между введениями) Высокая антибиотикорезистентность возбудителей инфекции Развитие суперинфекции (Enterobacter spp., Pseudomonas spp., грибы, Clostridium difficile)

Современные проблемы резистентности Грам (-) возбудителей в ОРИТ Микроорганизмы Клинически мало эффективны Enterobacteriaceae Пенициллины, цефалоспорины I-III, гентамицин Pseudomonas aeruginosa Антипсевдомонадные пенициллины, в том числе защищенные Acinetobacter Пенициллины, цефалоспорины I-IV, гентамицин, фторхинолоны

Активность антибиотиков в отношении P. aeruginosa Высокая, чувствительны > 80% штаммов Меропенем Имипенем Цефтазидим Цефепим Амикацин Умеренная, чувствительность вариабельная Цефоперазон Пиперациллин/тазобактам Ципрофлоксацин Нетилмицин Умеренная, чувствительны < 50% штаммов Гентамицин Тикарциллин/клавуланат Карбенициллин

При необходимости следует произвести 2-3 последовательных смены режимов антибактериального лечения. целесообразность периодической ротации антибиотиков не доказана .

Если пациент не отвечает на терапию: всегда предусматривать возможность наличия вторичных очагов инфекции (брюшная полость, синусы) произвести повторный забор культур

БЛАГОДАРЮ ЗА ВНИМАНИЕ