Презентация на тему: Генетический анализ

900igr.net

Генетические задачи решаются легко только тогда, когда они предварительно уже решены другими. Поэтому необходимо предостеречь тех, кто впервые приступает к генетическому анализу, от уныния и пессимизма, если их первые попытки окажутся неудачными. Александр Сергеевич Серебровский

Систематические отклонения в расщеплениях и их причины: Нарушение нормального расхождения хромосом в результате мейотических мутаций; Нарушение нормальной коньюгации гомологичных хромосом и негомологичное спаривание; Влияние перестроек хромосомы на расхождение гомологичных хромосом в мейозе. Нарушение нормального расхождения гомологов у гетерозигот по Робертсоновским транслокциям вследствие действия определенных мутаций; Предпочтительное расхождение гомологичных хромосом в мейозе (нарушение в наследовании гена R у кукурузы); Презиготический отбор, обусловленный различием в постмейотической активности отдельных генов и, как следствие, преимуществом в оплодотворении гаметами определенного генотипа; Расщепления, обусловленные наличием летальных мутаций, вызывающих избирательную гибель гамет; Системы самонесовместимости у растений; Неполная пенетрантность и экспрессивность – одна из причин отклонений в расщеплениях; Влияние способа размножения на расщепление. Наследование при нерегулярных типах полового размножения.


Систематическое отклонение в расщеплении заключается в увеличения или уменьшения числа наблюдаемых фенотипических (генетических) классов в модельных расщеплениях и/или в наличии статистически значимых отклонений в соотношении фенотипических (генетических) классов по сравнению с теоретически ожидаемым. Причины нарушений связаны: a) с неравновероятным участием гамет разного типа в оплодотворении вследствие следующих причин: нарушение механизма мейоза, приводящие к неправильному расхождению гомологичных кромосом; общие нарушения процесса гаметогенеза; неравновероятного участия гамет разного генотипа в оплодотворении: снижение подвижности; снижение жизнеспособности; снижение способности к оплодотворению; неспособность к оплодотворению (системы несовместимости у растений) и др. б) с разной жизнеспособностью и/или выживаемостью образовавшихся зигот (зиготическая леталь).

Этапы нарушения мейоза: вступление клеток в деление – мейотическое или митотическое, в течение которого работают одни и те же гены. Такие мутации могут вызывать митоз вместо мейоза – как следствие деление без редукции. этап коньюгации гомологичных хромосом: асинаптические мутации – приводят к полному или частичному подавлению коньюгации хромосом; десинаптические мутации – влияют на процессы хиазмообразования и терминализацию хиазм, уменьшают частоты рекомбинационных процессов. этап расхождения гомологов. Нарушение нормального расхождения хромосом в результате мейотических мутаций Проявление мейотических мутаций О нарушении правильного расхождения хромосом в мейозе может свидетельствовать частичная или полная мужская либо женская стерильность, появление анеуплоидов, а также отклонения в расщеплениях по каким-либо генам. Использование мейотических мутаций в ген. анализе Изучение мейотических мутантов позволяет объяснить наблюдаемые отклонения, выявить роль отдельных структур аппарата веретена деления, синапсиса и хиазмообразования и пр. в процессе мейотического деления. Тест на аллелизм позволяет выявить число генов, контролирующих мейоз, влияние каждого из них и их совместные эффекты.

Нарушение нормального расхождения хромосом в результате мейотических мутаций Асинапсис (асиндез) – явление, при котором коньюгация хромосом в мейозе либо отсутствует полностью, либо протекает с пониженной активностью. О том, что имел место асинапсис свидетельствует появление в метафазе I мейоза унивалентов (число которых может варьировать), что приводит к появлению анеуплоидных гамет. Причинами асинапсиса могут выступать следующие факторы: - влияние одного или большего числа определенных (асинаптических) генов; - утрата одного из коньюгантов; - апомиксис; - механические хромосомные различия (в структуре и числе хромосом, слишком ранняя или поздняя спирализация); - влияние внешних условий (температура, излучение и др.); - межвидовые скрещивания с недостаточной гомологичностью всех или части хромосом. При асинапсисе распределение хромосом по зародышевым клеткам будет случайным, в результате чего возникают гипер- и гипоплоидные гаметы. В крайних случаях асинапсис ведет к полной стерильности. Десинапсис – явление, наблюдаемое в диплотене профазы I мейоза, заключающееся в нерасхождении гомологичных хромосом, коньюгировавших в пахитене. Основной причиной десинапсиса является отсутствие хиазм и(или) их преждевременное исчезновение.

Нарушения мейоза на этапе вступления клеток в деление Мутация обнаружена у ржи. Обычно митотическое деление ядра микроспоры происходит после разрушения тетрады и ведет к формированию зрелого пыльцевого зерна. В мутантной линии митоз в микроспорах часто наступает сразу после мейоза, при этом в каждой микроспоре видны по 7 хромосом с центромерами, микроспоры остаются в общей оболочке и составляют «тетраду». После распада тетрад происходит расхождение хромосом в анафазе, причем к полюсам отходят целые хромосомы. Обнаружены разные варианты расхождения. В дальнейшем, аномальные микроспоры дегенерируютнормальные Нарушение нормального расхождения хромосом в результате мейотических мутаций «Деление в тетрадах» у ржи микроспороцит (2n) тетрада из 4 микроспор (n) микроспора (n) зрелое пыльцевое зерно микроспороцит (2n) тетрада из 4 микроспор (n) микроспора (n) зрелое пыльцевое зерно норма мутация Несмотря на то, что аномалии проявляются после мейоза, ее можно считать мейотической, так как она, вероятно, связана с нарушениями последнего этапа мейотического цикла, контролируемого одним геном.

Нарушения мейоза на этапе коньюгации гомологичных хромосом (Чадов и др. 1981-1986) частичный асинапсис гомологов приводит к спариванию и нерасхождению негомологичных хромосом, это свидетельствует о независимости расхождения хромосом от кроссинговера. Нарушение нормальной коньюгации гомологичных хромосом и негомологичное спаривание В опытах использовали самок дрозофилы, имевших нормальную метацентрическую хромосому 2 и два акроцентрика, каждый из которых содержал одно из структурно-нормальных плеч второй аутосомы – левое – F(2L) или правое F(2R), центромеру и участок прицентромерного гетерохроматина противоположного плеча (линия МАК-2). Структура линий MAK-2 у дрозофилы. Черным цветом обозначен центромерный гетерохроматин. Левое плечо F(2L) терминировано теломерным участком 2L, правое F(2R) - 2R. В гетерозиготе – 2/F(2L);F(2R) – центромера с окружающим ее гетерохроматином представлена трижды.

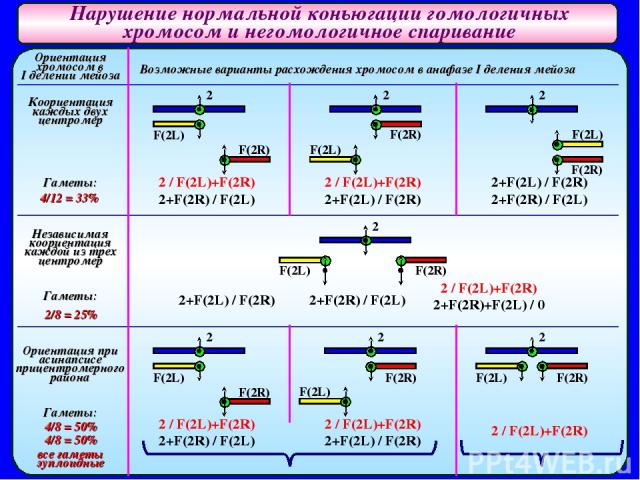
Нарушение нормальной коньюгации гомологичных хромосом и негомологичное спаривание Поскольку спариваться могут только две хромосомы, наличие трех центромер приводит к асинапсису прицентромерной области правого или левого акроцентрика. Было показано, что асинапсис прицентромерного района вызывает нерасхождение метацентрика с одним из акроцентриков (или двух акроцентриков) и образование анеуплоидных гамет. Для оценки частоты возникновения анеуплоидных гамет у самок МАК-2 была осуществлена серия анализирующих скрещиваний. Результаты которых позволяют сделать следующие выводы: у самок МАК-2 могут образовываться гаметы, анеуплоидные по второй хромосоме, большинство из которых оказывается зиготическими леталями (летальная мутация, эффект которой проявляется у эмбриона, личинки или взрослой особи, но не отражается на жизнеспособности несущей ее гаметы); общая частота жизнеспособных гамет у самок МАК-2 составляла около 90%, из них – 66,1% эуплоидные, и 24,2% - анеуплоидные (анеуплоидных потомков практически не было – они погибали, не достигая стадии имаго, часть яйцеклеток погибала из-за дистрофических явлений); частоту оценивали по отношению числа эу- и анеуплоидных гамет разного типа к общему числу яиц, отложенных самкой в данном скрещивании. Для объяснения полученных данных были рассмотрены три варианта возможных расхождений хромосом 2 у самок МАК-2 при разных типах их ориентации в мейозе и определен теоретически ожидаемый процент эу- и анеуплоидных гамет.
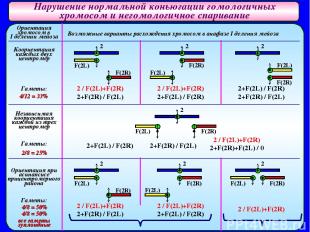
Нарушение нормальной коньюгации гомологичных хромосом и негомологичное спаривание Ориентация хромосом в I делении мейоза Коориентация каждых двух центромер Гаметы: 4/12 = 33% Независимая коориентация каждой из трех центромер Гаметы: 2/8 = 25% Ориентация при асинапсисе прицентромерного района Гаметы: 4/8 = 50% 4/8 = 50% все гаметы эуплоидные Возможные варианты расхождения хромосом в анафазе I деления мейоза 2 F(2L) F(2L) F(2L) F(2L) F(2L) F(2L) F(2L) F(2R) F(2R) F(2R) F(2R) F(2R) F(2R) F(2R) 2 2 2 2 2 2 2 / F(2L)+F(2R) 2+F(2R) / F(2L) 2 / F(2L)+F(2R) 2+F(2L) / F(2R) 2+F(2L) / F(2R) 2+F(2R) / F(2L) 2+F(2L) / F(2R) 2+F(2R) / F(2L) 2 / F(2L)+F(2R) 2+F(2R)+F(2L) / 0 2 / F(2L)+F(2R) 2+F(2R) / F(2L) 2 / F(2L)+F(2R) 2+F(2L) / F(2R) 2 / F(2L)+F(2R)

Нарушение нормальной коньюгации гомологичных хромосом и негомологичное спаривание При рассмотрении этих вариантов становится очевидным, что: частота эуплоидных гамет, полученная в опыте (66,2%), не может быть объяснена коориентацией двух центромер или независимой коориентацией каждой из трех центромер, так как в этих случаях ожидается возникновение 33% или 25% эуплоидных гамет соответственно. в основе возникновения эуплоидных гамет у самок МАК-2 лежит асинапсис прицентромерного района, приводящий к образованию либо равных количеств эу- и анеуплоидных гамет, либо только эуплоидных гамет. можно определить частоту эуплоидных гамет у самок МАК- 2 по доле анеуплоидных гамет. асинапсис прицентромерного района ведет к нерасхождению хромосом и отбору на уровне гамет; анеуплоидные гаметы лишь частично принимают участие в оплодотворении.

Влияние перестроек хромосомы на расхождение гомологичных хромосом в мейозе. Нарушение нормального расхождения гомологов у гетерозигот по Робертсоновским транслокциям вследствие действия определенных мутаций Типы перестроек и их фенотипическое проявление Парацентрические инверсии – не включают центромеру, т.е. инверсии хромосомного плеча – в хромосомах у самок дрозофилы увеличивают нерасхождение хромосом, несущих такие инверсии. На самках МАК-2, содержащих парацентрические инверсии в одном или обоих плечах, было показано резкое уменьшение доли эуплоидных гамет до 20-40%, причем увеличивалось нерасхождение акроцентрика, оппозитного инверсии; причина нерасхождения заложена в десинапсисе проксимальных районов хромосом, вызываемом инверсией. Робертсоновские транслокации – центрические слияния негомологичных хромосом, при которых из двух акроцентрических хромосом образуется одна метацентрическая (Rb-хромосома). Р.т. приводят к уменьшению числа хромосом в наборе без заметной утраты или избытка хроматина, так как число плеч остается неизменным; практически не изменяют структуру групп сцепления генов. Нормальный набор хромосом у мыши 20 пар акроцентрических хромосом (2n=40), при наличии одной Р.т. их 39: 18 парных акроцентриков, один метацентрик и два гомологичных ему акроцентрика. 8 Rb1 17 8 17 16 17 16 Rb7 17 Анализ скрещиваний самок, гетерозиготных по Rb-транслокации (Rb1 и Rb7) позволил выявить в ряде случаев значительное отклонение от ожидаемого расщепления: - общее уменьшение доли потомков с Rb-хромосомой (43%); - значительное уменьшение доли потомков с Rb-хромосомой при наличии мутаций по генам T, qk, Fu, Ki, t6 в мета- и акроцентрике (30-40%). Возможные причины: эмбриональная смертность особей с Rb или предпочтительное попадание Rb-хрмосомы в направительное тельце.

Влияние перестроек хромосомы на расхождение гомологичных хромосом в мейозе. Нарушение нормального расхождения гомологов у гетерозигот по Робертсоновским транслокциям вследствие действия определенных мутаций Оценка эмбриональной смертности показала, что она практически одинакова у потомков всех типов. Действие мутантных генов T, qk, Fu, Ki, t6, приводящее к сегрегационным нарушениям, осуществляется в ходе оогенеза не позднее первого деления мейоза, результатом этих нарушений является предпочтительное попадание акроцентрической хромосомы 17 в яйцеклетку, а Rb-хромосомы, соответственно, в полярное тельце. доля эуплоидных клеток без Rb-хромосомы – 69,4%. (анализ мейоза на стадии метафазы II ) T tf Rb7 + + Rb1 + tf tf tf ♀♀ X ♂♂ F1 Доля образовавшихся бластоцист не содержащих Rb-хромосомы в скрещивании составляет 67%. Доля родившихся мышат с генотипом без Rb-хромосомы в скрещивании составляет – 65,5%. tf tf Название мутаций и их фенотипическое проявление: tufted (tf) – потеря волос и возобновление их роста волнами от переднего конца тела к заднему; quaking (qk) – тремор, острая нехватка миелина в ЦНС; brachiury (T) – короткий хвост; t6 – нормальный хвост, проявляется в гетерозиготе T/t6 – бесхвостые мыши или мышки с очень коротким хвостом; Fused (Fu) – дефекты хвоста и позвоночника.

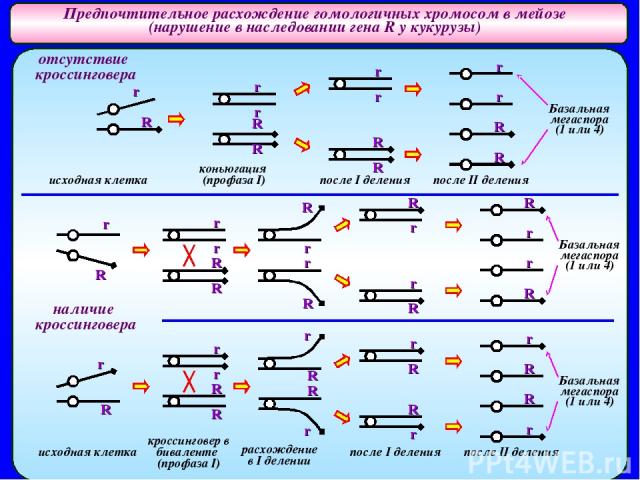
Предпочтительное расхождение гомологичных хромосом в мейозе (нарушение в наследовании гена R у кукурузы) Отклонения в расщеплениях по причине «предпочтительного» расхождения гомологов могут быть связаны с особенностями строения хромосом и формирования гаметофита у гетерозигот. P: ♀ RR ♂ rr P: ♀ rr ♂RR синие зерна белые зерна белые зерна синие зерна (аномальная линия) (нормальная линия) (аномальная линия) (нормальная линия) F1 F1 ♂белые X ♀ Rr (синие) ♂ X ♀ белые ♂белые X ♀ Rr (синие) ♂ X ♀ белые Fa: синие 0,7 синие 0,5 Fa: синие 0,3 синие 0,5 белые 0,3 белые 0,5 белые 0,7 белые 0,5 В расщеплениях преобладают потомки с фенотипом исходного родителя (матери) из аномальной линии. - Отклонения в расщеплениях могут быть связаны с нарушением процесса образования гамет у гетерозиготных материнских растений. Родс, 1942 В аномальной линии на конце длинного плеча 10 хромосомы присутствует небольшое гетерохроматиновое вздутие. Мейоз у гетерозиготных женских растений протекает нормально, однако гетерохроматиновое вздутие ведет себя в первом делении как «неоцентромера» - и оно отходит к полюсу раньше чем основная центромера. Во втором делении мейоза сохраняется ориентация хромосом на веретене, поэтому мегаспоры располагаются линейно. Зародышевый мешок развивается из наиболее удаленной от микропиле базальной мегаспоры. Если ген локализован вблизи «неоцентромеры» и на участке между геном и «неоцентромерой» не происходит кроссинговер, то вероятность попадания аллелей R и r в базальную мегаспору одинакова, и гаметы азного генотипа должны образовываться с одинаковой вероятностью – 50%. Если между геном и центромерой идет кроссинговер, то в базальную мегаспору обязательно попадет аномальная хромосома. Это увеличивает долю гамет с аномальной хромосомой. Избыток потомков определенного генотипа в Fa в этих скрещиваниях связан с наличием аномальной хромосомы в гетерозиготе и ее предпочтительным попаданием в мегаспору, из которой развивается женский гаметофит.
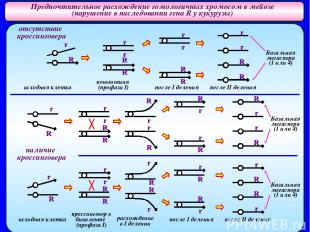
Предпочтительное расхождение гомологичных хромосом в мейозе (нарушение в наследовании гена R у кукурузы) Базальная мегаспора (1 или 4) Базальная мегаспора (1 или 4) Базальная мегаспора (1 или 4) исходная клетка коньюгация (профаза I) после I деления после II деления исходная клетка кроссинговер в биваленте (профаза I) после I деления после II деления расхождение в I делении r r r r r r r R R R R R R R R r r R r R R r r R r r r r R R R R r R R R R R r r r r R r r R r R R r отсутствие кроссинговера наличие кроссинговера

Презиготический отбор, обусловленный различием в постмейотической активности отдельных генов и, как следствие, преимуществом в оплодотворении гаметами определенного генотипа Наследование t-аллелей у мышей У мышей размер и форма хвоста контролируется серией множественных аллелей. Изучено два типа T-аллелей – рецессивные и доминантные с рецессивным летальным действием. Среди рецессивных есть летальные (tl), полулетальные (tsl) и жизнеспособные (tv). Все мутации проявляют плейотропный эффект, влияя не только на размер и форму хвоста , но и на фертильность, эмбриогенез и жизнеспособность. Генотип разных гетерозигот легко установить по фенотипу особи: +/+ - норма, t/+ - фенотипически не отличимы от нормы, T/+ - укороченный или изогнутый хвост, t/T – бесхосты или очень короткий хвост. P: ♀ T/t6 ♂ +/+ P: ♀ +/+ ♂ T/t6 бесхвостая нормальный нормальный бесхвостый Gp: T t6 + Gp: + T t6 F1: короткий хвост T/+ 21 F1: короткий хвост T/+ 36 нормальный хвост t6/+ 21 нормальный хвост t6/+ 93 Нарушение расщепления происходит в том случае, когда геторогаметен самец, причем в расщеплении преобладают мыши с генотипом t6/+. - Преимущественная передача t6-аллеля от самцов; - Эмбриональная гибель части зигот с генотипом T/+. Второе предположение было отвергнуто на основании одинаковой плодовитости мышей, установленной посредством реципрокных скрещиваний. Одинаковая плодовитость, отсутствие обнаруженных нарушений в протекании мейоза и гаметогенеза позволяют заключить, что в данном скрещивании в основе неменделевского расщепления лежит преимущественная передача гамет с аллелем t6 от самцов и преимущественное участие таких гамет в оплодотворении. Так как для t-аллелей характерно множественное действие, проявляемое в контроле фертильности, эмбриогенеза и жизнеспособности, преимущественное участие в оплодотворении гамет с t-аллелями связывают с различным уровнем постмейтической активности указанных генов в гаметах.
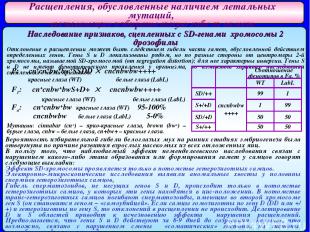
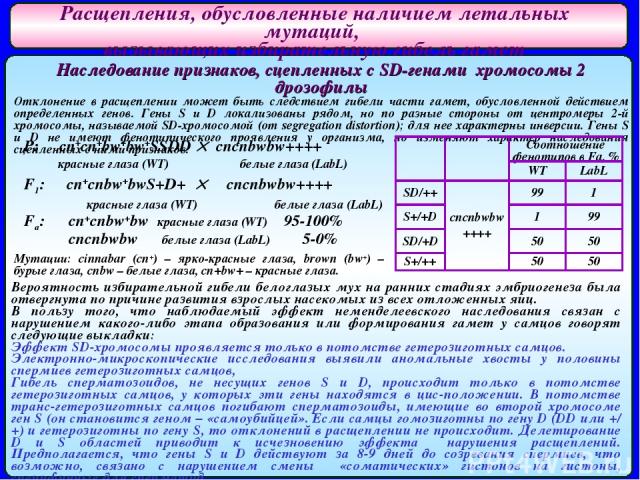
Расщепления, обусловленные наличием летальных мутаций, вызывающих избирательную гибель гамет Наследование признаков, сцепленных с SD-генами хромосомы 2 дрозофилы Отклонение в расщеплении может быть следствием гибели части гамет, обусловленной действием определенных генов. Гены S и D локализованы рядом, но по разные стороны от центромеры 2-й хромосомы, называемой SD-хромосомой (от segregation distortion); для нее характерны инверсии. Гены S и D не имеют фенотипического проявления у организма, но изменяют характер наследования сцепленных с ними признаков. P: cn+cn+bw+bw+SSDD cncnbwbw++++ красные глаза (WT) белые глаза (LabL) F1: ♂ cn+cnbw+bwS+D+ ♀ cncnbwbw++++ красные глаза (WT) белые глаза (LabL) Fa: cn+cnbw+bw красные глаза (WT) 95-100% cncnbwbw белые глаза (LabL) 5-0% Вероятность избирательной гибели белоглазых мух на ранних стадиях эмбриогенеза была отвергнута по причине развития взрослых насекомых из всех отложенных яиц. В пользу того, что наблюдаемый эффект неменделеевского наследования связан с нарушением какого-либо этапа образования или формирования гамет у самцов говорят следующие выкладки: Эффект SD-хромосомы проявляется только в потомстве гетерозиготных самцов. Электронно-микроскопические исследования выявили аномальные хвосты у половины спермиев гетерозиготных самцов, Гибель сперматозоидов, не несущих генов S и D, происходит только в потомстве гетерозиготных самцов, у которых эти гены находятся в цис-положении. В потомстве транс-гетерозиготных самцов погибают сперматозоиды, имеющие во второй хромосоме ген S (он становится геном – «самоубийцей». Если самцы гомозиготны по гену D (DD или +/+) и гетерозиготны по гену S, то отклонений в расщеплении не происходит. Делетирование D и S областей приводит к исчезновению эффекта нарушения расщеплений. Предполагается, что гены S и D действуют за 8-9 дней до созревания спермиев, что возможно, связано с нарушением смены «соматических» гистонов на гистоны, специфичные для сперматид. Мутации: cinnabar (cn+) – ярко-красные глаза, brown (bw+) – бурые глаза, cnbw – белые глаза, cn+bw+ – красные глаза. ♂ ♀ Соотношение фенотипов в Fa, % WT LabL SD/++ cncnbwbw ++++ 99 1 S+/+D 1 99 SD/+D 50 50 S+/++ 50 50
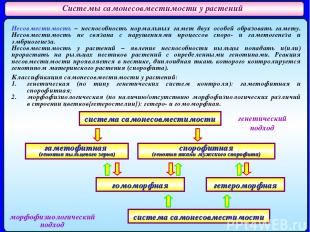
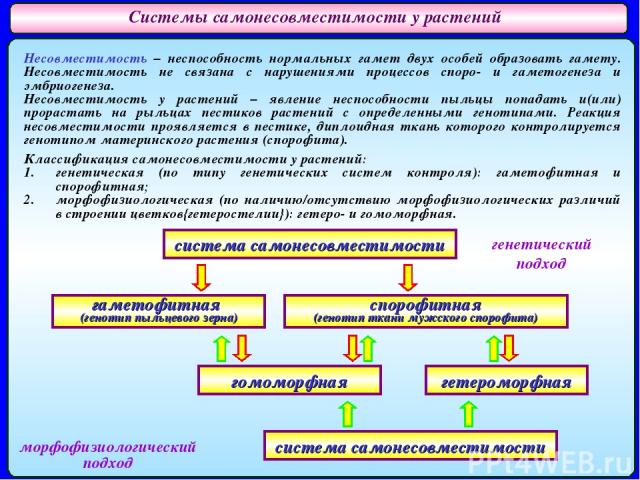
Системы самонесовместимости у растений Несовместимость – неспособность нормальных гамет двух особей образовать гамету. Несовместимость не связана с нарушениями процессов споро- и гаметогенеза и эмбриогенеза. Несовместимость у растений – явление неспособности пыльцы попадать и(или) прорастать на рыльцах пестиков растений с определенными генотипами. Реакция несовместимости проявляется в пестике, диплоидная ткань которого контролируется генотипом материнского растения (спорофита). Классификация самонесовместимости у растений: генетическая (по типу генетических систем контроля): гаметофитная и спорофитная; морфофизиологическая (по наличию/отсутствию морфофизиологических различий в строении цветков{гетеростелии}): гетеро- и гомоморфная. система самонесовместимости гаметофитная (генотип пыльцевого зерна) спорофитная (генотип ткани мужского спорофита) гомоморфная гетероморфная система самонесовместимости генетический подход морфофизиологический подход
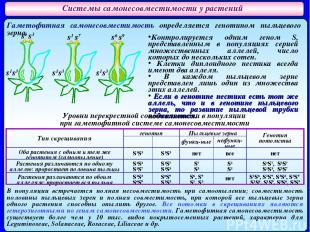
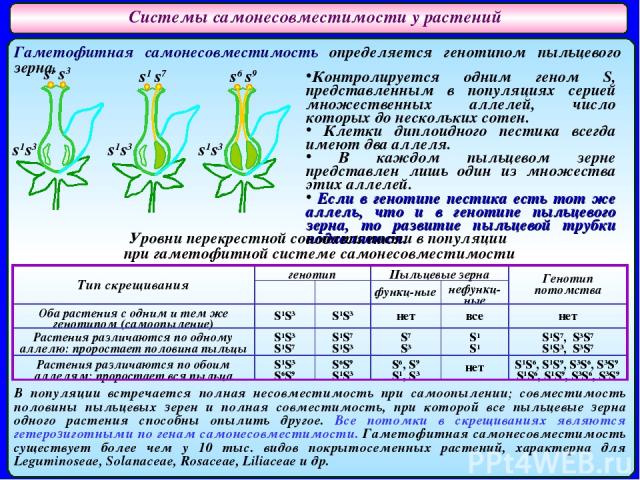
Системы самонесовместимости у растений Гаметофитная самонесовместимость определяется генотипом пыльцевого зерна. s1 s3 s1 s7 s6 s9 s1s3 s1s3 s1s3 Контролируется одним геном S, представленным в популяциях серией множественных аллелей, число которых до нескольких сотен. Клетки диплоидного пестика всегда имеют два аллеля. В каждом пыльцевом зерне представлен лишь один из множества этих аллелей. Если в генотипе пестика есть тот же аллель, что и в генотипе пыльцевого зерна, то развитие пыльцевой трубки подавляется. В популяции встречается полная несовместимость при самоопылении; совместимость половины пыльцевых зерен и полная совместимость, при которой все пыльцевые зерна одного растения способны опылить другое. Все потомки в скрещиваниях являются гетерозиготными по генам самонесовместимости. Гаметофитная самонесовместимость существует более чем у 10 тыс. видов покрытосеменных растений, характерна для Leguminoseae, Solanaceae, Rosaceae, Liliaceae и др. Уровни перекрестной совместимости в популяции при гаметофитной системе самонесовместимости Тип скрещивания генотип Пыльцевые зерна Генотип потомства ♀ ♂ функц-ные нефункц-ные Оба растения с одним и тем же генотипом (самоопыление) S1S3 S1S3 нет все нет Растения различаются по одному аллелю: проростает половина пыльцы S1S3 S1S7 S1S7 S1S3 S7 S3 S1 S1 S1S7, S3S7 S1S3, S3S7 Растения различаются по обоим аллелям: проростает вся пыльца S1S3 S6S9 S6S9 S1S3 S6, S9 S1, S3 нет S1S6, S1S9, S3S6, S3S9 S1S6, S1S9, S3S6, S3S9

Системы самонесовместимости у растений Спорофитная самонесовместимость определяется генотипом ткани мужского спорофита, в котором развивается пыльца, контролируется, как правило серией множественных аллелей одного гена. Гетероморфная самонесовместимость характерна для видов, растения которых имеют цветки различного строения (гетеростелия). Например, у гречихи, примулы наблюдается дистилия – два типа цветков, различающихся по длине столбика и тычинок. Опыление и прорастание пыльцы осуществляется при скрещивании растений с цветками разных типове – легитимное опыление. Переопыление растений с разным типом цветка – иллегитимное происходит редко и дает небольшой выход семян. При изучении результатов легитимного и иллегитимного опыления было установлено, что гетероморфность цветка контролируется одним геном, причем короткостолбчатость – доминантный признак. Гомоморфная спорофитная самонесовместимость широко распространена в природе, она встречается у ряда семейств цветковых растений (Compositae, Sterculiaceae, Crucifera и др. Этот тип самонесовместимости не связан с различиями в строении цветков. При гомоморфной спорофитной самонесовместимости встречаются различные взаимодействия между аллелями, например, доминирование. В отсутствии доминирования пыльца, сформированная на гетерозиготном растении – S1S2, не прорастает ни на рыльце гомозиготных S1S1 и S2S2, ни на рыльце гетерозиготных растений S1S2. При доминировании пыльца с гетерозиготных растений не прорастает на рыльцах растений, содержащих в генотипе доминантный аллель, если доминирование проявляется в пыльнике и пестике. Пыльца с гомозиготных рецессивных растений прорастает на рыльцах гомозиготных доминантных и на рыльцах гетерозиготных растений. Например, пыльца с растения с генотипом S1S1 прорастает на рыльцах S2S2 и S1S2 если S2 доминирует над S1. При спорофитном контроле и наличии доминирования возможно образование в популяции гомозигот по аллелям самонесовместимости.
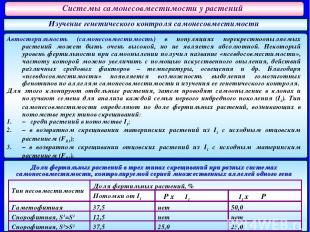
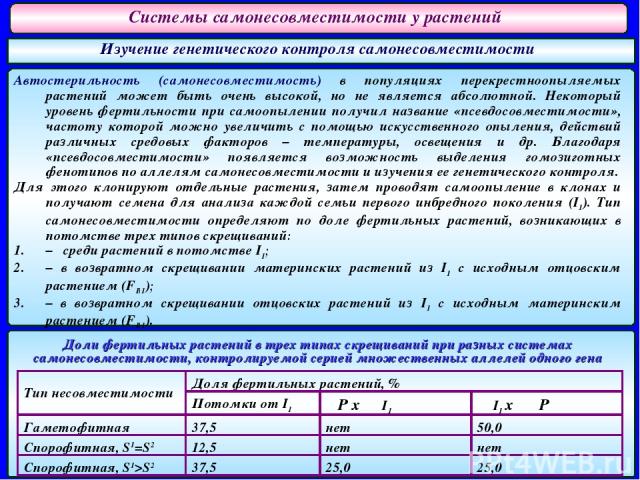
Системы самонесовместимости у растений Изучение генетического контроля самонесовместимости Автостерильность (самонесовместимость) в популяциях перекрестноопыляемых растений может быть очень высокой, но не является абсолютной. Некоторый уровень фертильности при самоопылении получил название «псевдосовместимости», частоту которой можно увеличить с помощью искусственного опыления, действий различных средовых факторов – температуры, освещения и др. Благодаря «псевдосовместимости» появляется возможность выделения гомозиготных фенотипов по аллелям самонесовместимости и изучения ее генетического контроля. Для этого клонируют отдельные растения, затем проводят самоопыление в клонах и получают семена для анализа каждой семьи первого инбредного поколения (I1). Тип самонесовместимости определяют по доле фертильных растений, возникающих в потомстве трех типов скрещиваний: – среди растений в потомстве I1; – в возвратном скрещивании материнских растений из I1 с исходным отцовским растением (FВ1); – в возвратном скрещивании отцовских растений из I1 с исходным материнским растением (FВ1). Доли фертильных растений в трех типах скрещиваний при разных системах самонесовместимости, контролируемой серией множественных аллелей одного гена Тип несовместимости Доля фертильных растений, % Потомки от I1 ♀P x ♂I1 ♀ I1 x ♂ P Гаметофитная 37,5 нет 50,0 Спорофитная, S1=S2 12,5 нет нет Спорофитная, S1>S2 37,5 25,0 25,0

Системы самонесовместимости у растений Изучение генетического контроля самонесовместимости Если в скрещиваниях наблюдается отклонения от ожидаемого соотношения фертильных и стерильных растений, то это будет свидетельствовать о немоногенном контроле самонесовместимости. Дигенный гаметофитный контроль самонесовместимости Обнаружен у ржи, ячменя, овсянницы, сахарной свеклы. У ржи гены S и Z наследуются независимо, причем каждый из них представлен в популяции серией множественных аллелей. Наблюдается комплементарное взаимодействие этих генов: пыльцевые зерна, в генотипе которых имеются те же аллели обоих генов, что и в генотипе пестика, не способны прорастать на них. Например, в скрещивании ♀S1S2Z3Z4 x ♂S1S3Z3Z4 не прорастет пыльца с генотипами S1Z3 и S1Z4, остальная пыльца – S3Z3 и S3Z4 – функционирует нормально. Очевидно, что в этом случае в потомстве могут появиться растения, гомозиготные по генам самонесовместимости: S1S3Z3Z3 и S1S3Z4Z4.

Зависимость расщепления от выживаемости зигот разного генотипа Неодинаковая жизнеспособность зигот разного генотипа может быть связана с доминантным или рецессивным летальнымы мутациями, возникающими в гаметах родительских особей. Они могут реализовываться на разных стадиях эмбриогенеза или в постэмбриональнои периоде. Естественно, что гибель части зигот влияет на характер расщепления. Влияние на расщепление доминантных генов с рецессивным летальным действием Доминантные гены с рецисивным летальным действием обладают плейотропным эффектом: с одной стороны, они определяют доминантный характер проявления какого-либо признака в гетерозиготе, с другой – вызывают гибель особей в гомозиготе, т.е. проявляют свое летальное действие как рецессив. Такие гены известны у многих животных – желтая окраска мышей, коротконогость у кур, линейная чешуйчатость у карпов, платиновая окраска у лис, окраска ширази у овец и др. Они вызывают отклонение от расщепления 3:1, превращая его в расщепление 2:1. Анализ расщеплений с участием доминантных генов с рецессивным летальным действием осложняется тем, что на сравнительно небольших выборках расщепление 3:1 и 2:1 не всегда можно различить, а статистический метод проверки по методу X2 не позволяет делать выбора из гипотез.

Зависимость расщепления от выживаемости зигот разного генотипа Влияние на расщепление доминантных генов с рецессивным летальным действием Пример. Если при скрещивании желтых мышей между собой получится расщепление 65 желтых: 32 черных, то по методу X2 не отвергаются две гипотезы: 1 – расщепление в опыте соответствует расщеплению 3:1, X2=3,29, p>0,05; 2 – расщепление в опыте соответствует расщеплению 2:1, X2=0,17, p>0,05. Только на больших выборках расщепление 2:1 отличимо от расщепления 3:1. При суммировании данных по наследованию желтой окраски у мышей, расщепление при скрещивании желтых мышей между собой было 2386 желтых: 1235 черных, Σ=3621, X2=0,96, при Н0 – 2:1 (при Н0 – 3:1 X2=160. Сложнее выяснить, что отклонение есть и оно обусловлено разной жизнеспособностью зигот в том случае, когда гибель части зигот осуществляется на постэмбриональной стадии. Поэтому необходимо вести контроль плодовитости и отхода в потомстве, если есть подозрение о наличии летальности. Основанием для предположения о наличии летальности является невозможность получения единообразного потомства при разведении в себе особей определенного фенотипа. Влияние рецессивных летальных мутаций на расщепление Рецессивные аутосомные и сцепленные с полом летали, вызывая гибель гомозигот в скрещиваниях гетерозигот по летали, могут влиять на расщепление по генам, сцепленным с леталью. При этом соотношение потомков в расщеплении зависит от расстояния между изучаемым геном и леталью, а также от типа гетерозиготы – в цис- или транс-положении гены вводятся в гетерозиготу. Для выявления летали ставят разные проверочные скрещивания.

Неполная пенетрантность и экспрессивность – одна из причин отклонений в расщеплениях Полное проявление гена – одно из условий осуществления менделевских расщеплений. Установлено, что некоторые гены проявляют свое действие не у всех особей, в генотипе которых они присутствуют. Впервые это явление было обнаружено Н.В.Тимофеевым-Ресовским на дрозофиле при изучении наследования рецессивной мутации, вызывающей прерывание второй жилки крыла (ri – radius incompletus), локализованной на хромосоме 3. Выводы: некоторые признаки хорошо проявляются только при определенных условиях среды (влажности, температуры, и др.) или в определенных генотипах; неполно пенетрировать и по разному экспрессироваться могут как рецессивные, так и доминантные мутации в гомо – и в гетерозиготном состоянии; процент пенетрантности может быть неодинаков в разных скрещиваниях, вызывая нарушения нормального расщепления; высшим показателем пенетрантности признака считают пенетрантность, проявляемую в потомстве гомозигот, где все особи должны иметь одинаковый генотип. У разных высокоинбредных линий, гомозиготных по данному гену, доля особей, проявляющих мутантный фенотип, варьировала от 60 до 100%. Способность гена проявляться фенотипически была названа пенентрантностью. Также было показано, что фенотипическое выражение этого признака изменчиво, т.е. размер радиальной жилки крыла у дрозофилы является количественным признаком (В.А. Ратнер) и степень нехватки этой жилки может варьировать. Степень выраженности признака была названа экспрессивностью. Крыло D. melanogaster с различной экспрессией гена radius incompletus, ri: а – крыло в контрольной линии. ri С (1- проксимальный фрагмент. 2 – дистальный фрагмент радиальной жилки крыла. L2); б – крыло в линии позитивной селекции (s+); в – крыло в линии негативной селекции (s-).
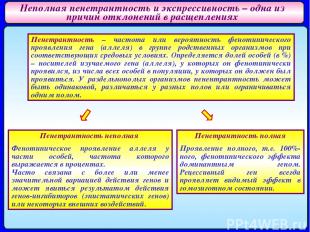
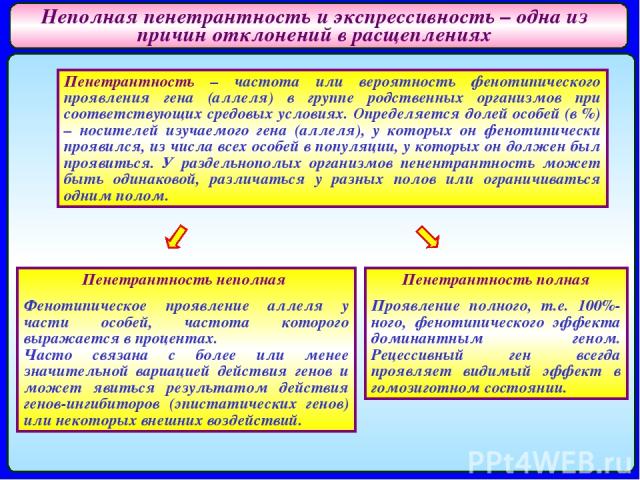
Неполная пенетрантность и экспрессивность – одна из причин отклонений в расщеплениях Пенетрантность – частота или вероятность фенотипического проявления гена (аллеля) в группе родственных организмов при соответствующих средовых условиях. Определяется долей особей (в %) – носителей изучаемого гена (аллеля), у которых он фенотипически проявился, из числа всех особей в популяции, у которых он должен был проявиться. У раздельнополых организмов пенентрантность может быть одинаковой, различаться у разных полов или ограничиваться одним полом. Пенетрантность неполная Фенотипическое проявление аллеля у части особей, частота которого выражается в процентах. Часто связана с более или менее значительной вариацией действия генов и может явиться результатом действия генов-ингибиторов (эпистатических генов) или некоторых внешних воздействий. Пенетрантность полная Проявление полного, т.е. 100%-ного, фенотипического эффекта доминантным геном. Рецессивный ген всегда проявляет видимый эффект в гомозиготном состоянии.
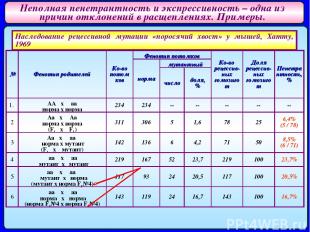
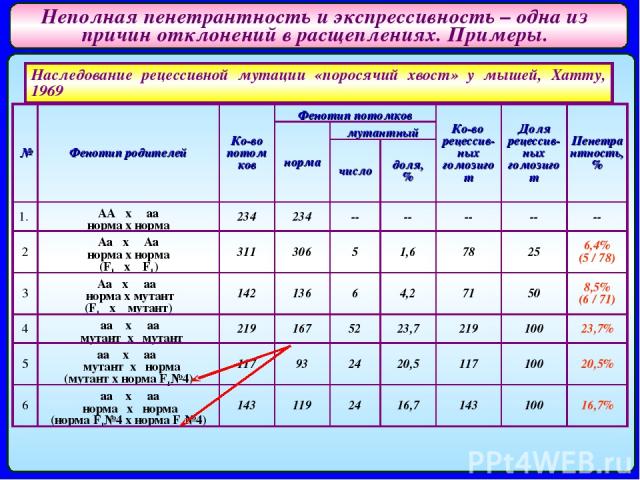
Неполная пенетрантность и экспрессивность – одна из причин отклонений в расщеплениях. Примеры. Наследование рецессивной мутации «поросячий хвост» у мышей, Хатту, 1969 № Фенотип родителей Ко-во потомков Фенотип потомков Ко-во рецессив-ных гомозигот Доля рецессив-ных гомозигот Пенетрантность, % норма мутантный число доля, % 1. AA x aa норма x норма 234 234 -- -- -- -- -- 2 Aa x Aa норма x норма (F1 x F1) 311 306 5 1,6 78 25 6,4% (5 / 78) 3 Aa x aa норма x мутант (F1 x мутант) 142 136 6 4,2 71 50 8,5% (6 / 71) 4 aa x aa мутант x мутант 219 167 52 23,7 219 100 23,7% 5 aa x aa мутант x норма (мутант x норма F1№4) 117 93 24 20,5 117 100 20,5% 6 aa x aa норма x норма (норма F1№4 x норма F1№4) 143 119 24 16,7 143 100 16,7%

Неполная пенетрантность и экспрессивность – одна из причин отклонений в расщеплениях. Примеры. Наследование признаков со сменой доминирования P: ♀ HH ♂ hh P: ♀ hh ♂ HH рогатая кумолый кумолая рогатый F1: ♀ Hh ♂ Hh кумолая рогатый F2: ♀♀ ¼ HH ½ Hh ¼ hh ♂♂ ¼ HH ½ Hh ¼ hh ¼ рогатые ¾ кумолые ¾ рогатые ¼ кумолые На проявление признаков у гетерозигот могут оказывать влияние гормоны. Зависимые от пола признаки по разному проявляются у гетерозиготных самцов и самок.. У некоторых пород овец (дорсетская и суффолдская) рогатость доминирует у самцов, но рецессивна у самок (гетерозиготный баран рогат, ярка – комолая): У гороха чувствительность гетерозигот к вирусу желтой мозаики зависит от температуры. Если гетерозиготные растения выращивать при температуре 18°С и ниже они устойчивы к вирусу, при 27°С и выше чувствительны, в диапазоне 18-27°С вариативность. Проявление признака у гомозигот не зависит от температуры (AA – чувствительны, aa – устойчивы). У гетерозиготных растений некоторых сортов пшеницы проявление ветвистости колоса зависит от продолжительности светового дня – на коротком дне у гетерозигот проявляется ветвистость, на длинном – развивается нормальный колос. ВСЕ ОПЫТЫ СЛЕДУЕТ ПРОВОДИТЬ В ОДИНАКОВЫХ КОНТРОЛИРУЕМЫХ УСЛОВИЯХ

Влияние способа размножения на расщепление. Наследование при нерегулярных типах полового размножения. Партеногенез - форма полового размножения, при которой зародыш развивается из неоплодотворенной яйцеклетки. Обеспечивает воспроизводство и резкое увеличение численности популяции, когда контакт разнополых особей крайне редок. В случае диплоидного соматического партеногенеза (амейотического) все потомки, развивающиеся из диплоидной клетки гомо- или гетерозиготной оказываются одинаковыми и имеют генотип матери (расщепление в потомстве не происходит). В случае гаплоидного (мейотического или генеративного) партеногенеза развитие организма осуществляется из нормальной гаплоидной яйцеклетки. Гетерозиготный материнский организм может образовывать два сорта гамет (A и a) с равной вероятностью и дальнейщее расщепление зависит от соотношения выживших гаплоидных особей с разным генотипом. Гиногенез - форма полового размножения, при которой зародыш развивается из неоплодотворенной яйцеклетки, является частным случаем партеногенеза. Происходит с участием обоих родителей, но без оплодотворения: сперматозоиды лишь стимулируют развитие яйцеклеток (активацию могут вызвать сперматозоиды других видов). Характерен для рыб. Андрогенез - форма полового размножения, при которой зародыш развивается за счет слияния пронуклеусов двух сперматозоидов. Может происходить у видов, для которых характерна полиспермия – проникновение в клетку нескольких сперматозоидов (иглокожие, моллюски, насекомые). Описан у табака, кукурузы, наездников. Андрогенез идет, если яйцеклетка по каким-либо причинам неспособна к оплодотворению. Арренотокия - форма полового размножения, частный случай партеногенеза, при котором из оплодотворенных яйцеклеток развиваются диплоидные самки, а из неоплодотворенных - гаплоидные самцы, причем плоидность сохраняется только в клетках зародышевого пути, в соматических клетках число хромосом вторично удваивается. Характерна для организмов с гапло- диплоидным определением пола (пчелы, осы, наездники, муравьи). При партеногенетическом развитии соотношение полов обычно отличается от соотношения 1:1 - в потомстве, как правило преобладают самки. Связывают это с большой гибелью неоплодотворенных гаплоидных яиц, из которых развиваются самцы.

Пример влияния способа размножения на расщепление. Наследование при нерегулярных типах полового размножения. Наследование признака окраски глаз у пчел P: ♀ HH ♂ hh коричневые белые F1: ♀ Hh ♂ HH коричневые коричневые G♀: H и h G♂: H F2: ♀♀ ½ HH ½ Hh коричневые коричневые ♂♂ ½ HH ½ hh коричневые белые В семье пчел количество самок в сотни раз больше чем, самцов-трутней. Это служит причиной нарушения нормального расщепления. Наблюдается сильное отклонение от нормального 3:1 в пользу преобладания коричневоглазых особей.