Презентация на тему: Углерод и его оксиды


Положение в периодической системе Положение в периодической системе Строение атома углерода Аллотропные модификации углерода (алмаз, графит, аморфный углерод) Значение

С + О2 CO2 С + О2 CO2 C + 2S CS2 C + 2F2 CF4 (с др. галогенами не идет) SnO2 + 2C Sn + 2CO 3C + Fe2O3 2Fe + 3CO

C + 2H2 CH4 C + 2H2 CH4 C + Si SiC 3C + 4Al AL4C3

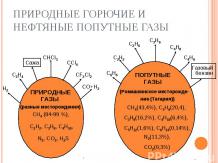
1. В свободном виде: алмаз, графит, уголь. 1. В свободном виде: алмаз, графит, уголь. 2. В связанном состоянии – карбонаты: СаСО3 – мрамор, мел, известняк; MgCO3 – магнезит. 3. Углерод входит в состав всех живых организмов, нефти, природных газов, углей.

Бесцветный, без запаха газ малорастворимый в воде, ядовит (0,1%) Бесцветный, без запаха газ малорастворимый в воде, ядовит (0,1%) Химические свойства 2СО + О2 2CO2 3CO + Fe2O3 2Fe + 3CO2 Получение угарного газа: С + СО2 2CO

1. Безцветный газ, без запаха, в 1,5 раза тяжелее воздуха, не поддерживает горения. 1. Безцветный газ, без запаха, в 1,5 раза тяжелее воздуха, не поддерживает горения. 2. Получение в лаборатории: СаСО3 + НCl CaCl2 + CO2 + H2O 3. Получение в промышленности: - СаСО3 CO2 + CaO

СО2 + Н2О ↔ Н2СО3 СО2 + Н2О ↔ Н2СО3 СO2 + NaOH NaHCO3 CO2 + 2NaOH Na2CO3 + H2O CO2 + MgO MgCO3 CO2 + 2Mg 2MgO + C C + CO2 2CO CO2 + Ca(OH)2 CaCO3↓+ H2O

Для тушения пожаров Для тушения пожаров В пищевой промышленности: для газирования минеральных вод, шипучих напитков и хранения продуктов (сухой лед) Для получения соды