Презентация на тему: Понятие об ЭДС

МОУ СОШ №5 ст. Бриньковской Понятие об ЭДС Электролиты и неэлектролиты электролитическая диссоциация Учитель химии Беба Е.А.

ЦЕЛИ УРОКА: 1. Сформировать понятия об электролитах и неэлектролитах. 2. Рассмотреть механизм диссоциации веществ с ковалентной полярной и ионной связью. 3.Ввести понятие степень диссоциации.

САМОСТОЯТЕЛЬНАЯ РАБОТА 1. В 50 г воды растворили 50 г щелочи. Вычислите массу полученного раствора и массовую долю щелочи в растворе. 2. Используя рисунок 24 стр. 134 сравните растворимость нитрата калия и хлорида натрия при 60 градусах.

Виды связи в соединениях Ковалентная ( полярная и неполярная)- это связь, образованная с помощью общих электронных пар. Ионная связь- связь между ионами, осуществляемая электростатическим притяжением.
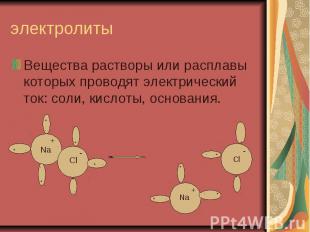
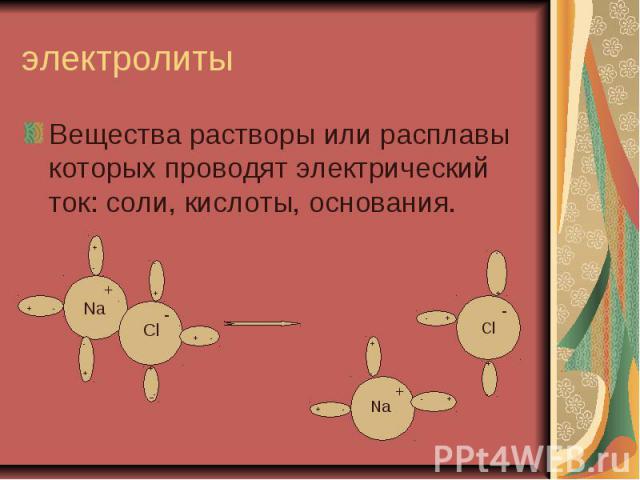
электролиты Вещества растворы или расплавы которых проводят электрический ток: соли, кислоты, основания.

неэлектролиты Вещества растворы и расплавы которых тока не проводят Простые вещества Органические вещества Нерастворимые оксиды и т. д.

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ РАСПАД ЭЛЕКТРОЛИТА НА ИОНЫ ПРИ РАСТВОРЕНИИ ИЛИ РАСПЛАВЛЕНИИ Ориентация Гидратация Диссоциация Для веществ с ионной связью

Электролитическая диссоциация Для веществ с ковалентной полярной связью Ориентация Гидратация Ионизация Диссоциация

Упражнения: Уравнения диссоциации: NaOH = Na + OH K Cl = K + Cl H Cl = H + Cl K2SO4 = 2K +SO4

Закрепление темы KOH = NaNO3 = MgSO4 = H2SO4 = Домашнее задание стр. 143-148 з.1-3.