Презентация на тему: Карбонаты

Тема урока: «Карбонаты» Цель урока: Изучить химические свойства солей угольной кислоты – карбонатов и гидрокарбонатов; приобрести навыки в решении экспериментальных и расчетных задач

Тест – экспресс 1) Электронная конфигурация атома углерода? 2) Разновидности простого вещества, образованные одним и тем же химическим элементом? 3) Количество электронов на внешней электронной оболочке элементов IV группы главной подгруппы? 4) Летучие водородные соединения углерода и кремния? 5) Формула высших оксидов элементов IVа группы? 6) Масса 0,5 моль свинца? 7) Объем 2 моль метана при н.у.? 8) Чего больше по массе в угарном газе – кислорода или углерода? 9) Степень окисления углерода в угарном и углекислом газах? 10) Где больше атомов – в 1 литре угарного или в 1 литре углекислого газах?

ОТВЕТЫ 1) Аллотропные видоизменения 2) 1s22s22p 3) Четыре 4) Метан СН4, силан SiH4 5) ЭО2 6) m=M.n; m=103,5г 7) V=Vm.n; V=44,8л 8) По массе больше кислорода 9) +2; +4 10) В 1л углекислого газа

Фокус-покус для народа: Стоит лишь подуть сквозь воду, Как она легко-легко Превратиться в молоко! СО2 + Са(ОН)2 ↔ СаСО3 + Н2О

Действие сильной кислоты может служить качественной реакцией на карбонаты: СаСО3 + 2Н+ ↔ Са2+ + Н2О + СО2↑

Как можно собрать СО2 М(воздуха)=29, т.е. СО2 тяжелее воздуха Метод вытеснения воды невозможен из-за протекания реакции: Метод вытеснения воздуха, т.к. М(СО2)=44; CO2+H2O↔H2CO3

Угольная кислота диссоциирует ступенчато: 1.H2CO3 ↔ Н+ + HCO3- 2. HCO3- ↔ Н+ + CO32-
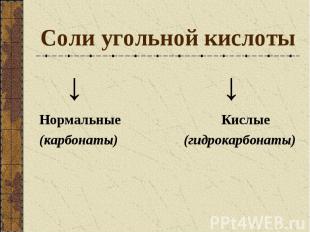
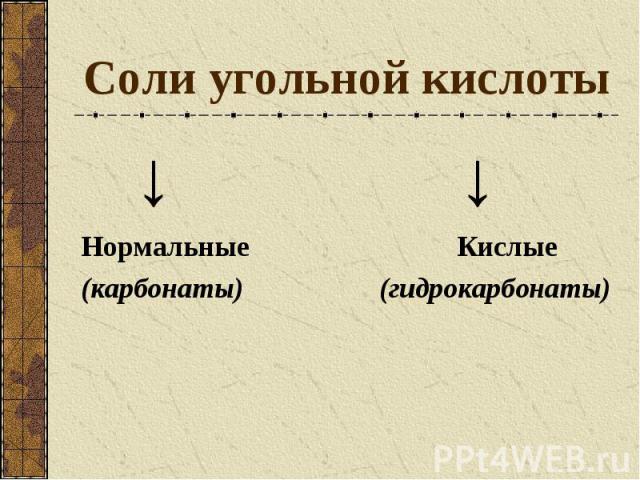
Соли угольной кислоты ↓ ↓ Нормальные Кислые (карбонаты) (гидрокарбонаты)
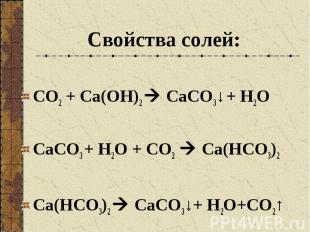
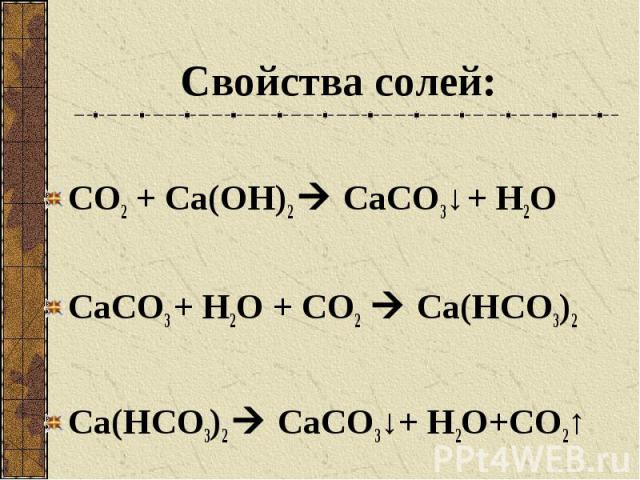
Свойства солей: СО2 + Са(ОН)2 СаСО3↓ + Н2О СаСО3 + Н2О + СО2 Са(НСО3)2 Са(НСО3)2 СаСО3↓+ Н2О+СО2↑

Пещера красная Пещера красная

Сталагмиты

Сталактит «Пузатый»

Сталактит «Огненный»
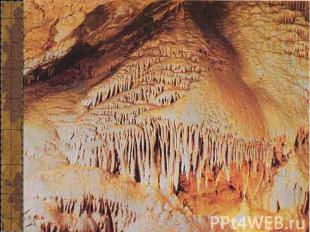



Изучением карстовых пещер занимается наука – спелеология

Соли угольной кислоты: Мрамор, известняк, мел – СаСО3 На земле живут три брата Из семейства Карбонатов. Старший брат – красавец Мрамор, Славен именем Карары, Превосходный зодчий. Он Строил Рим и Парфенон.

Доломит CaCO3. MgCO3 – обычно содержит глины и известняки, применяется для получения извести, солей магния, как удобрение(доломитовая мука). Доломит CaCO3. MgCO3 – обычно содержит глины и известняки, применяется для получения извести, солей магния, как удобрение(доломитовая мука). Малахит Cu2(ОН)2CO3 – хрупкий, цвет ярко-зеленый, темно-зеленый, блестит. Из него изготовляют художественно-декоративные предметы,используют для получения меди.

Сидерит FeCO3 – минерал бурого цвета, служит рудой для получения железа. Сидерит FeCO3 – минерал бурого цвета, служит рудой для получения железа. Кальцинированная сода Na2CO3 – белый порошок, используется в производстве стекла, мыла, бумаги, моющих средств. Питьевая сода NaHCO3 – белый порошок, плохо растворяется в воде, используют в медицине, в пищевой промышленности, как средство огнетушения.

Презентация разработки темы в курсе 9 класса. Подготовила учитель химии ОГРИНА СВЕТЛАНА ЮРЬЕВНА
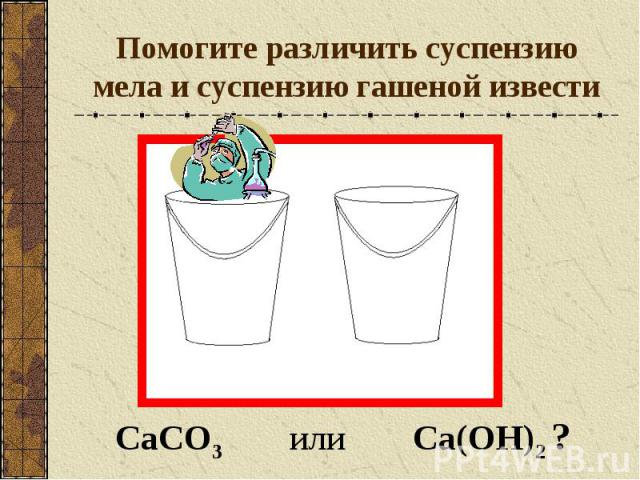
Помогите различить суспензию мела и суспензию гашеной извести