Презентация на тему: Фотометрический анализ

Фотометрический анализ III курс, д/о Преподаватель Ельчищева Юлия Борисовна

Оптические методы анализа Атомно-адсорбционный анализ – основанный на поглощении световой энергии атомами анализируемых веществ. Молекулярно-адсорбционный анализ – анализ по поглощению света молекулами анализируемого вещества и сложными ионами (в бл.УФ, видимой, бл.ИК). К нему относим фотоэлектроколориметрию, спектрофотометрию, ИК-спектроскопию. Анализ по поглощению и рассеиванию световой энергии взвешанными частицами анализируемого вещества, т.е. дисперсными системами (турбидиметрия, нефелометрия). Люминесцентный анализ – основанный на измерении излучения, выделенного возбужденными частицами исследуемого объекта.

Электронный спектр поглощения (излучения)
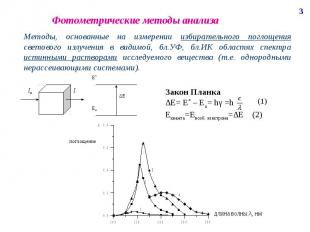
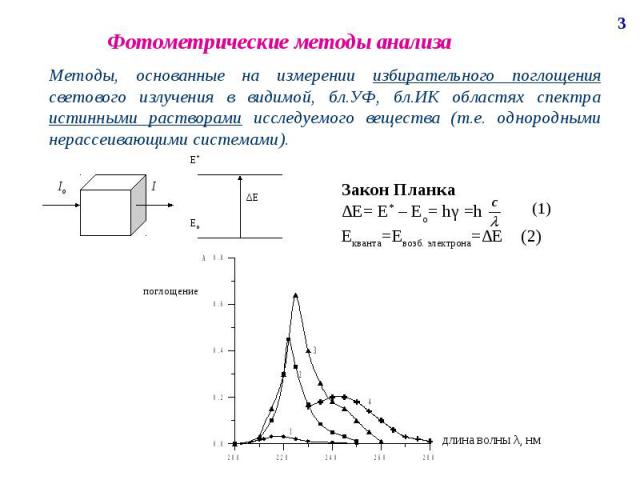
Фотометрические методы анализа
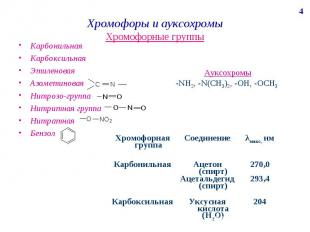
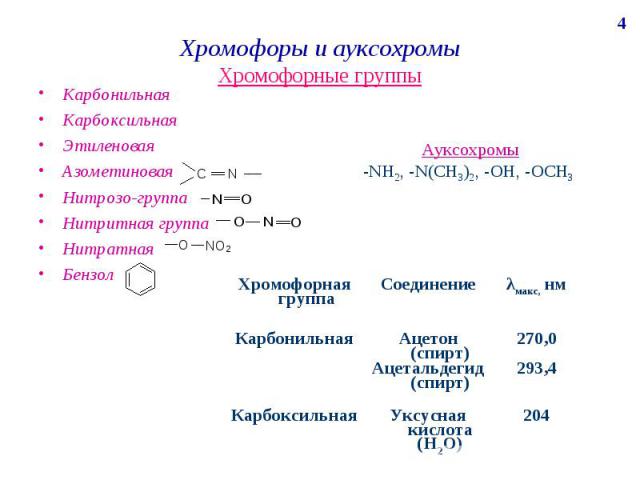
Хромофоры и ауксохромы Хромофорные группы Карбонильная Карбоксильная Этиленовая Азометиновая Нитрозо-группа Нитритная группа Нитратная Бензол

Поглощающие системы в фотометрии Растворы акво-комплексов (ионов), обладающие поглощением в видимой области спектра; их молярный коэффициент поглощения (ε) не выше n·102. Органические соединения. Растворы солей элементов в высших степенях окисления (MnO4-, Cr2O72- и т.д.) Растворы комплексов металлов с неорганическими (ε ~ n·103) и органическими (ε ~ n·104) лигандами.

Основные законы поглощения I. Закон Бугера-Ламберта
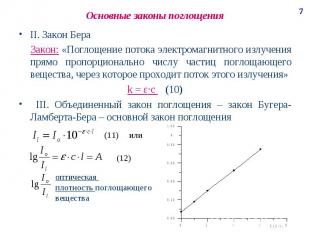
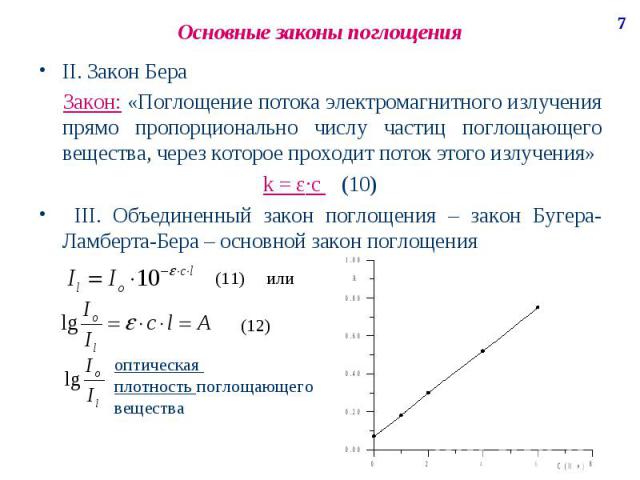
Основные законы поглощения II. Закон Бера Закон: «Поглощение потока электромагнитного излучения прямо пропорционально числу частиц поглощающего вещества, через которое проходит поток этого излучения» k = ε·c (10) III. Объединенный закон поглощения – закон Бугера-Ламберта-Бера – основной закон поглощения
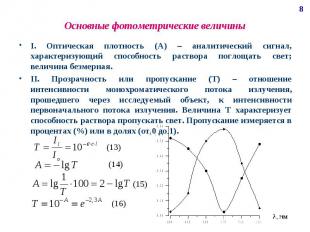
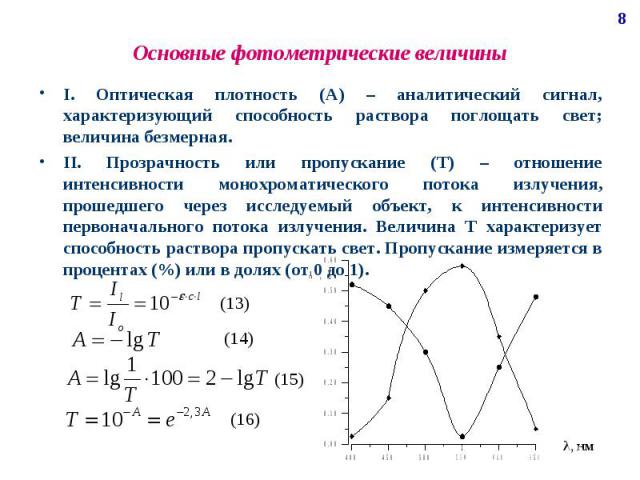
Основные фотометрические величины I. Оптическая плотность (А) – аналитический сигнал, характеризующий способность раствора поглощать свет; величина безмерная. II. Прозрачность или пропускание (Т) – отношение интенсивности монохроматического потока излучения, прошедшего через исследуемый объект, к интенсивности первоначального потока излучения. Величина Т характеризует способность раствора пропускать свет. Пропускание измеряется в процентах (%) или в долях (от 0 до 1).

Основные фотометрические величины III. Молярный коэффициент светопоглощения (погашения) (ε) – является основной характеристикой поглощения любой системы при данной длине волны; отражает индивидуальные свойства окрашенных соединений и является их определяющей характеристикой. Физический смысл: молярный коэффициент светопоглощения представляет собой оптическую плотность раствора с концентрацией 1 моль/л, помещенного в кювету с толщиной поглощающего слоя 1 см; имеет размерность см2/моль. Молярный коэффициент светопоглощения зависит от: длины волны падающего света; температуры раствора; природы растворенного вещества. Молярный коэффициент светопоглощения является мерой чувствительности данной фотометрической реакции. Молярный коэффициент светопоглощения бывает истинным и кажущимся. Значение ε характеризует два существенно важных свойства поглощающей системы: постоянство значения ε говорит о соблюдении основного закона поглощения в определенном интервале концентраций; значение ε удобно использовать для сравнительной оценки чувствительности фотометрической реакции

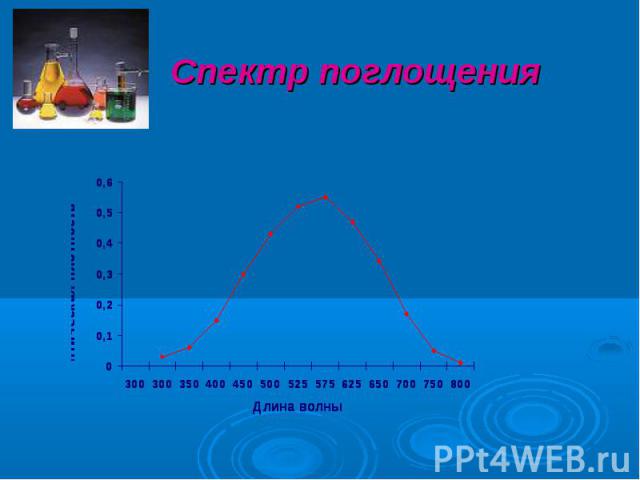
Спектр поглощения – графическое изображение распределения поглощаемой веществом энергии по длинам волн. Спектры поглощения имеют одну и ту же форму независимо от толщины слоя раствора или концентрации вещества в растворе и характеризуются сохранением положения максимума при одной и той же длине волны. Закон аддитивности (правило) – Фирордт (1873) Если в растворе содержится n светопоглощающих компонентов, которые не вступают друг с другом в химическое взаимодействие, то при условии соблюдения основного закона светопоглощения оптическая плотность такого раствора будет равна сумме парциальных оптических плотностей всех содержащихся в растворе светопоглощающих компонентов.
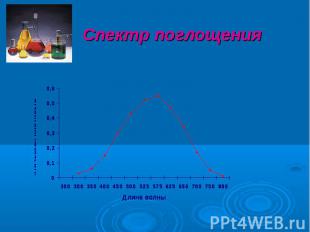
Спектр поглощения

Причины отклонения от закона Бугера-Ламберта-Бера Поведение поглощающих систем подчиняется закону Б-Л-Л при условии: монохроматичности светового потока; отсутствии химических изменений в поглощающей системе; постоянстве коэффициента преломления. Причины отклонения: I. кажущиеся: физические (инструментальные) – немонохроматичность светового потока; рассеяние света; случайные излучения. химические: изменение ионной силы раствора; изменение концентрации раствора; изменение степени сольватации (гидратации); изменение концентрации ионов [H+]; изменение степени диссоциации комплексного соединения при разбавлении. II. истинные – изменение коэффициента преломления.
![Влияние концентрации [H+] на формы существования частиц Влияние концентрации [H+] на формы существования частиц](https://fs1.ppt4web.ru/images/95289/121277/310/img13.jpg)
Влияние концентрации [H+] на формы существования частиц

Фотометрическая реакция К фотометрическим реакциям прибегают в следующих случаях: определяемый компонент не окрашен или интенсивность его светопоглощения мала; полосы поглощения определяемого и посторонних компонентов перекрываются; определяемый компонент присутствует в виде множества различных химических форм. Требования к фотометрическим реакциям В результате реакции должно образовываться вещество, поглощающее свет в УФ или видимой области спектра; фотометрические реакции, несмотря на различии в их химизме, должны протекать быстро, количественно, избирательно; поглощение продуктов фотометрической реакции должно быть хорошо воспроизводимым и постоянным во времени; важно, чтобы закон Б-Л-Б выполнялся в широком интервале концентраций определяемого вещества; если фотометрический реагент окрашен, то реакция должна обладать высокой контрастностью; образующееся комплексное соединение должно быть прочным; значение ε должно быть достаточно большим, т.е. реакция должна быть чувствительной.









![Влияние концентрации [H+] на формы существования частиц Влияние концентрации [H+] на формы существования частиц](https://fs1.ppt4web.ru/images/95289/121277/640/img13.jpg)