Презентация на тему: Химическая связь в комплексных соединениях


Альфред Вернер – первым попытался объяснить химическую связь в комплексных соединениях. Альфред Вернер – первым попытался объяснить химическую связь в комплексных соединениях. 1893 г. – статья Вернера «О строении неорганических соединений». 1913 г. – присуждение Вернеру Нобелевской премии. Дальнейшее развитие химии КС связано с именем Чугаева. Созданная им школа объединила русских ученых Черняева, Гринберга, их учеников Яцимирского, Кукушкина.

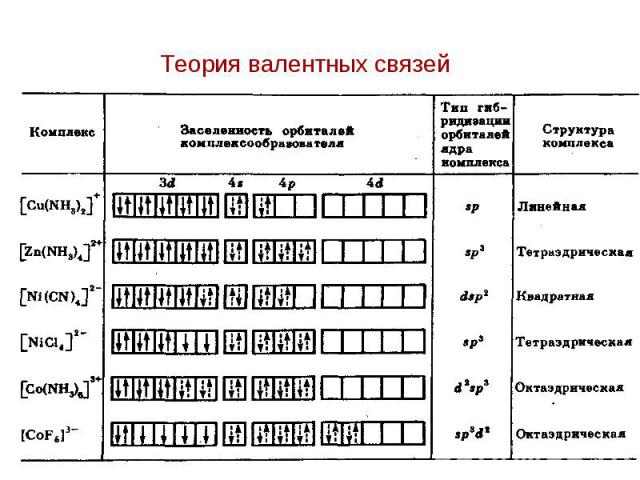
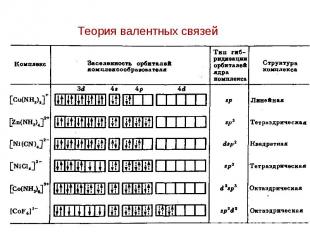
Теория валентных связей Теория валентных связей 1. Связь между комплексообразователем и лигандами является донорно-акцепторной. Лиганды предоставляют электронные пары, а центральный атом комплекса – свободные орбитали. Мерой прочности связи служит степень перекрывания орбиталей.

2. Орбитали комплексообразователя подвергаются гибридизации. 2. Орбитали комплексообразователя подвергаются гибридизации. Тип гибридизации зависит от природы и электронной структурой центрального атома (Ц.А.). Геометрия комплекса определяется характером гибридизации орбиталей Ц.А. Существует октаэдрические, тетраэдрические, квадратные и линейные комплексные ионы.

3. Магнитные свойства комплексного иона зависят от заселенности орбиталей комплексообразователя: 3. Магнитные свойства комплексного иона зависят от заселенности орбиталей комплексообразователя: а) При наличии неспаренных электронов комплекс парамагнитен. б) Полное отсутствие неспаренных электронов (все электроны спарены) обуславливает диамагнетизм комплексного соединения.

4. Наиболее прочные связи образуются при использовании комплексообразователем своих d–орбиталей. 4. Наиболее прочные связи образуются при использовании комплексообразователем своих d–орбиталей. Типичные комплексообразователи - элементы, у которых d–орбитали заполнены электронами не полностью.
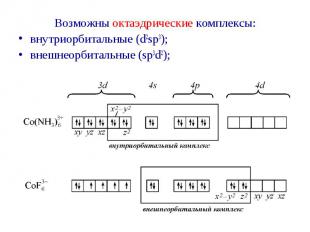
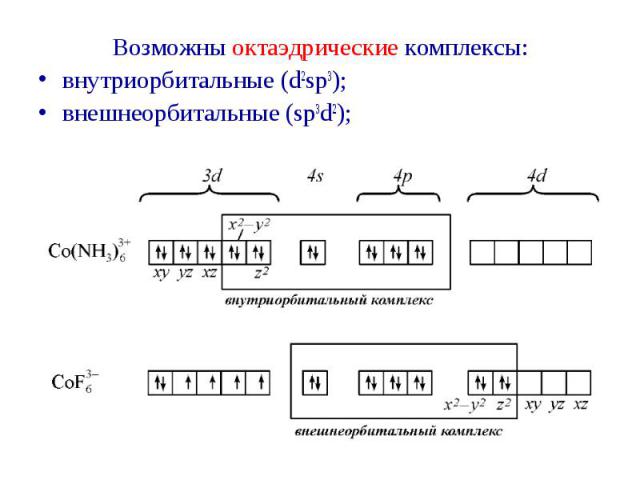
Возможны октаэдрические комплексы: Возможны октаэдрические комплексы: внутриорбитальные (d2sp3); внешнеорбитальные (sp3d2);

Электронное строения атома кобальта: Электронное строения атома кобальта: При образовании иона Со3+ освобождается 4s-орбиталь, а на 3d-орбитали остается 6 валентных электронов: Со3+

1. Лиганды, создающие сильное поле, могут влиять на комплексообразователь. Электроны Ц.А. могут спариваться и освобождать две 3d-орбитали, которые заселяются электронными парами лигандов (внутриорбитальная гибридизация). NH3 – создает сильное поле.
![Все валентные электроны спарены. Комплекс [Co(NH3)6]3+ - диамагнитный, что согла Все валентные электроны спарены. Комплекс [Co(NH3)6]3+ - диамагнитный, что согла](https://fs1.ppt4web.ru/images/95289/121275/310/img9.jpg)
Все валентные электроны спарены. Комплекс [Co(NH3)6]3+ - диамагнитный, что согласуется с экспериментом.

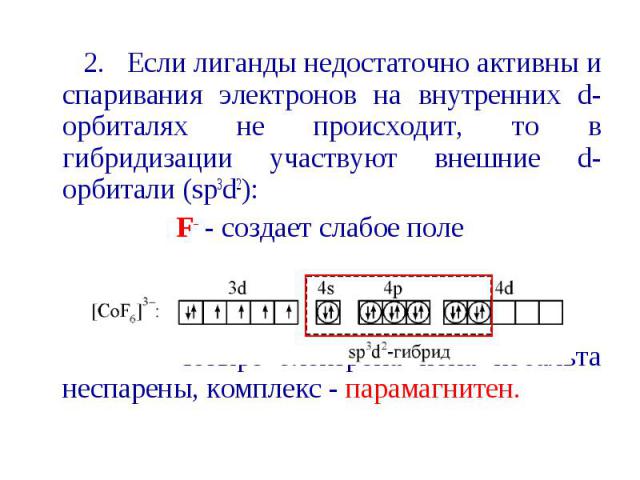
2. Если лиганды недостаточно активны и спаривания электронов на внутренних d-орбиталях не происходит, то в гибридизации участвуют внешние d-орбитали (sp3d2): 2. Если лиганды недостаточно активны и спаривания электронов на внутренних d-орбиталях не происходит, то в гибридизации участвуют внешние d-орбитали (sp3d2): F– - создает слабое поле Четыре электрона иона кобальта неспарены, комплекс - парамагнитен.

3. Если комплексообразователь при спаривании валентных электронов на внутренних d-орбиталях может освободить только одну квантовую ячейку, то d2sp3-гибридизация осуществиться не может. 3. Если комплексообразователь при спаривании валентных электронов на внутренних d-орбиталях может освободить только одну квантовую ячейку, то d2sp3-гибридизация осуществиться не может.

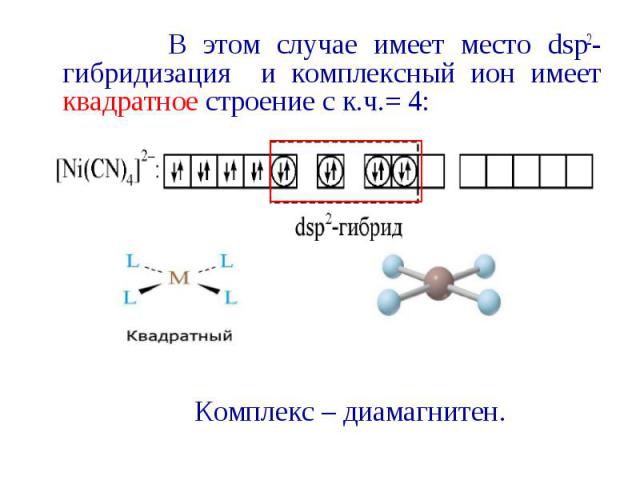
В этом случае имеет место dsp2-гибридизация и комплексный ион имеет квадратное строение с к.ч.= 4: В этом случае имеет место dsp2-гибридизация и комплексный ион имеет квадратное строение с к.ч.= 4:
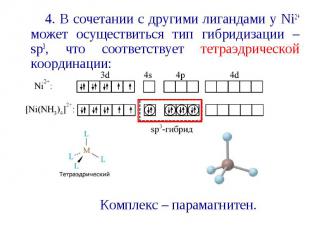
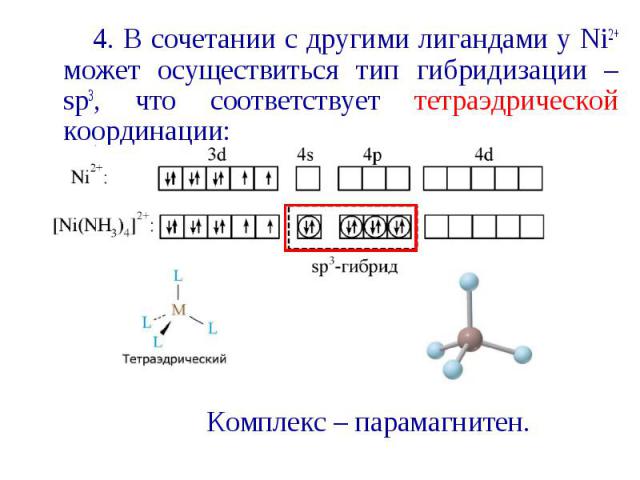
4. В сочетании с другими лигандами у Ni2+ может осуществиться тип гибридизации – sp3, что соответствует тетраэдрической координации: 4. В сочетании с другими лигандами у Ni2+ может осуществиться тип гибридизации – sp3, что соответствует тетраэдрической координации:
Теория валентных связей Теория валентных связей

Недостатки метода ВС: Недостатки метода ВС: Не объясняет и не предсказывает оптические свойства (цветность). Не объясняет силу лигандов, т.е. способность их спаривать или не спаривать орбитали комплексообразователя. Не позволяет определить конкуренцию между тетраэдрическими и квадратными комплексами.

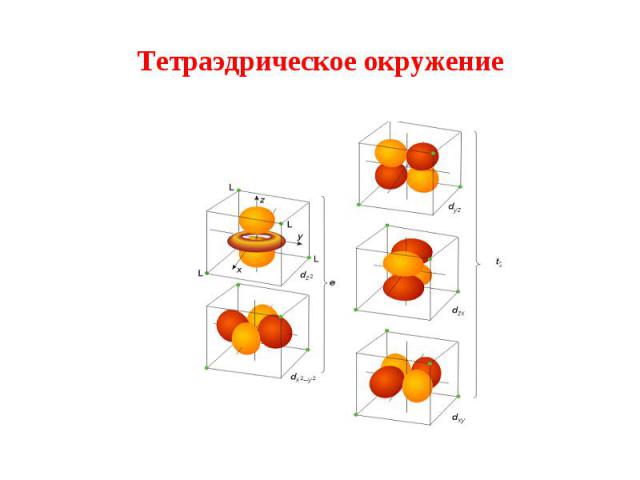
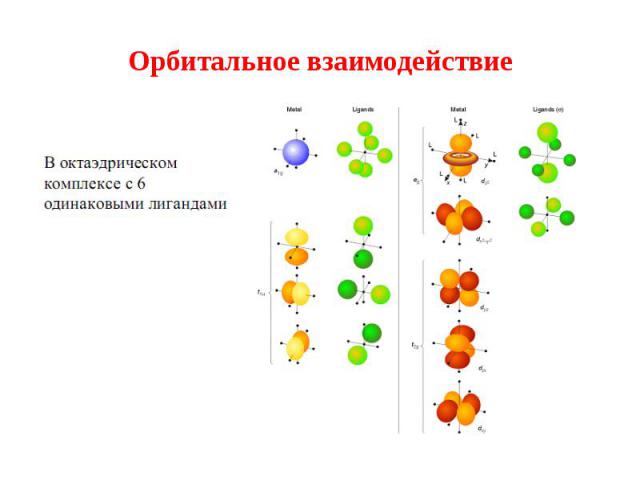
2. Теория кристаллического поля 2. Теория кристаллического поля Химическая связь между комплек-сообразователем и лигандами ионная или иондипольная. Лиганды считаются точечными электрическими зарядами, не имеющими пространственной структуры. Комплексообразователь рассматривается как квантовохимическая система, состоящая из ядра и электронов.

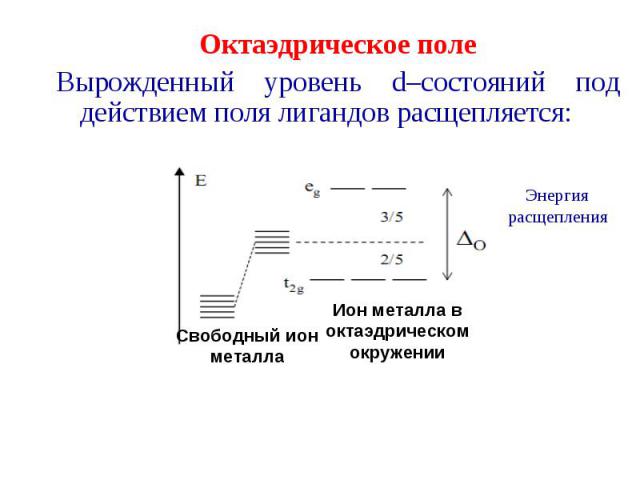
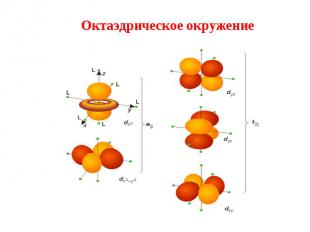
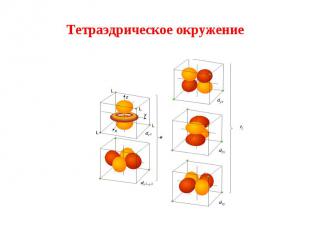
Октаэдрическое поле Октаэдрическое поле Вырожденный уровень d–состояний под действием поля лигандов расщепляется:
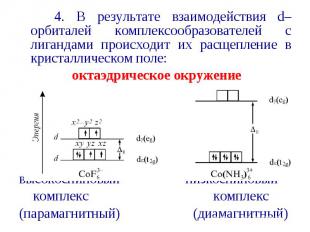
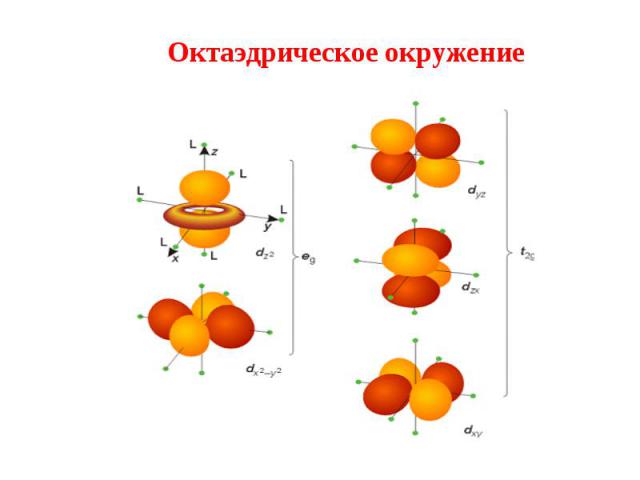
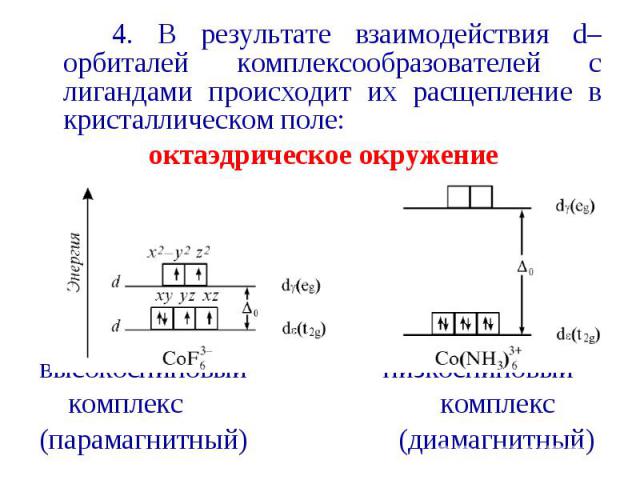
4. В результате взаимодействия d–орбиталей комплексообразователей с лигандами происходит их расщепление в кристаллическом поле: 4. В результате взаимодействия d–орбиталей комплексообразователей с лигандами происходит их расщепление в кристаллическом поле: октаэдрическое окружение высокоспиновый низкоспиновый комплекс комплекс (парамагнитный) (диамагнитный)


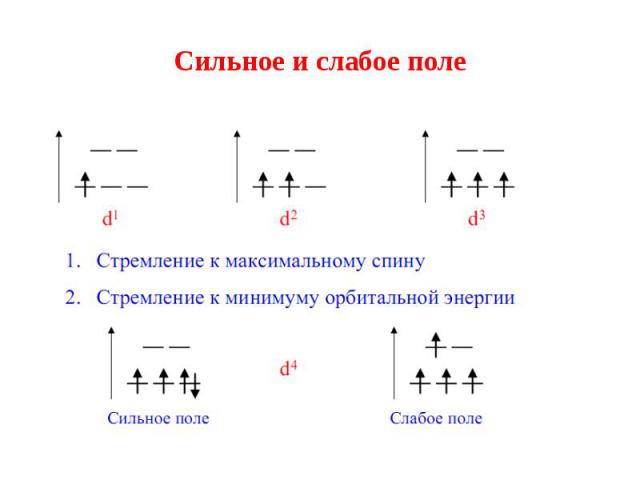
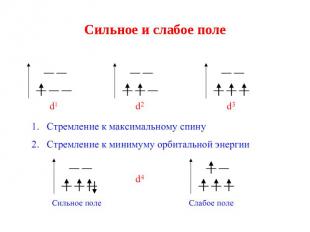
5. Значение энергии расщепления (∆) тем больше, чем сильнее воздействие лиганда. 5. Значение энергии расщепления (∆) тем больше, чем сильнее воздействие лиганда. В спектрохимическом ряду лиганды расположены в порядке убывания воздействия на ион d-элемента: CО>CN->NO2->NH3>NCS->H2O>F->OH->Cl->Br->I-

6. Заполнение орбиталей происходит в соответствии с правилом Хунда: 6. Заполнение орбиталей происходит в соответствии с правилом Хунда: а) если имеются лиганды со слабым расщепляющим воздействием (создают слабое поле), то электроны заполняют все орбитали по одному. б) в комплексах с лигандами с большим расщепляющим воздействием (создают сильное поле) сначала заполняются электронами орбитали с меньшей энергией:

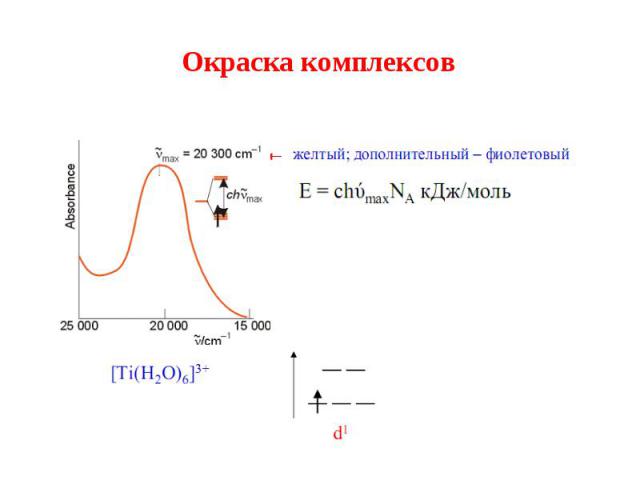
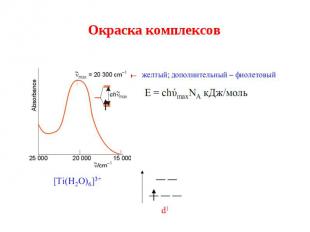
Окраску комплексов теория кристаллического поля объясняет поглощением света комплексными соединениями, при котором происходит переход электронов в возбужденного состояние. Окраску комплексов теория кристаллического поля объясняет поглощением света комплексными соединениями, при котором происходит переход электронов в возбужденного состояние. Поглощается квант света, энергия которого равна параметру расщепления: Δ=hν

Теория кристаллического поля Теория кристаллического поля

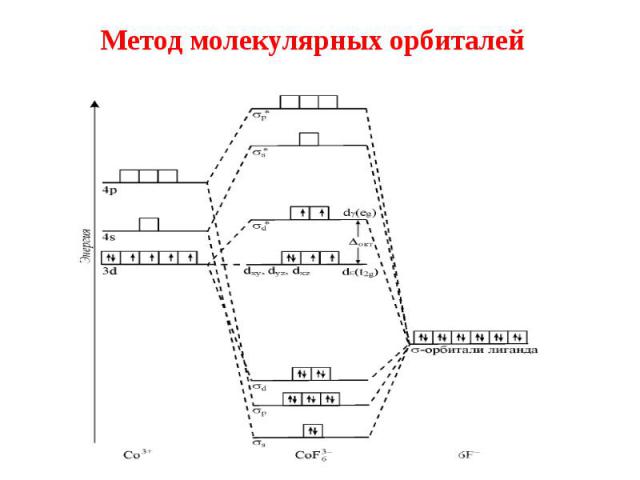
3. Метод молекулярных орбиталей 3. Метод молекулярных орбиталей 1. В ММО учитывается детальная электронная структура не только комплексообразователя, но и лигандов. 2. Комплекс рассматривается как единая квантово-механическая система, в которой отдельные атомы и молекулы теряют свои индивидуальные черты. 3. Валентные электроны системы располагаются на многоцентровых МО, охватывающих ядра комплексообразователя и всех лигандов, входящих в состав комплекса.
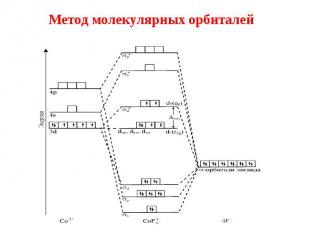
Метод молекулярных орбиталей Метод молекулярных орбиталей










![Все валентные электроны спарены. Комплекс [Co(NH3)6]3+ - диамагнитный, что согласуется с экспериментом. Все валентные электроны спарены. Комплекс [Co(NH3)6]3+ - диамагнитный, что согласуется с экспериментом.](https://fs1.ppt4web.ru/images/95289/121275/640/img9.jpg)