Презентация на тему: Амфотерные свойства воды

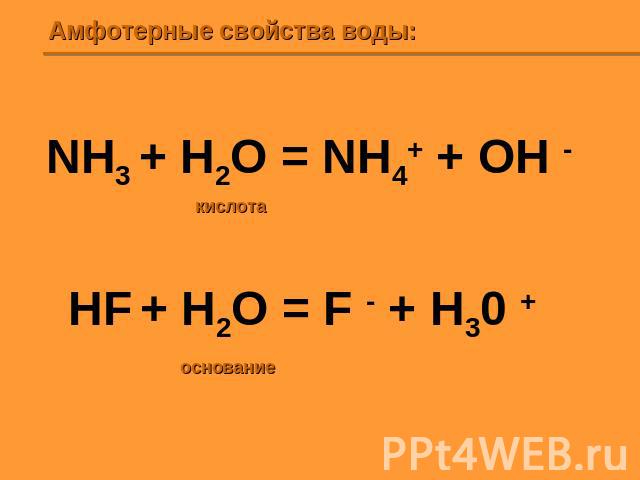
Амфотерные свойства воды: NH3 + H2O = NH4+ + OH - HF + H2O = F - + H30 +

Выберите правильные ответы: 1. Катион – это:а) ион меди; б) атом серы; в) ион серы; г) атом меди. 2. Анион – это:а) ион натрия; б) ион аммония; в) карбонат-ион; г) ион водорода. 3. Окраска фенолфталеина в растворе, полученном при взаимодействии калия с водой:а) синяя; б) малиновая; в) желтая; г) бесцветная. 4. Формула вещества, образующего при диссоциации сульфат-ионы:а) Na2S; б) SO3; в) Na2SO4; г) BaSO4. 5. Формула вещества, образующего при диссоциации сульфат-ионы и ионы водорода:а) КНS; б) КНSO3; в) Na2S; г) NaHSO4.

Выберите правильные ответы: 1. Катион – это:а) ион меди; б) атом серы; в) ион серы; г) атом меди. 2. Анион – это:а) ион натрия; б) ион аммония; в) карбонат-ион; г) ион водорода. 3. Окраска фенолфталеина в растворе, полученном при взаимодействии калия с водой:а) синяя; б) малиновая; в) желтая; г) бесцветная. 4. Формула вещества, образующего при диссоциации сульфат-ионы:а) Na2S; б) SO3; в) Na2SO4; г) BaSO4. 5. Формула вещества, образующего при диссоциации сульфат-ионы и ионы водорода:а) КНS; б) КНSO3; в) Na2S; г) NaHSO4.
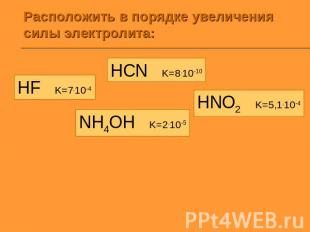
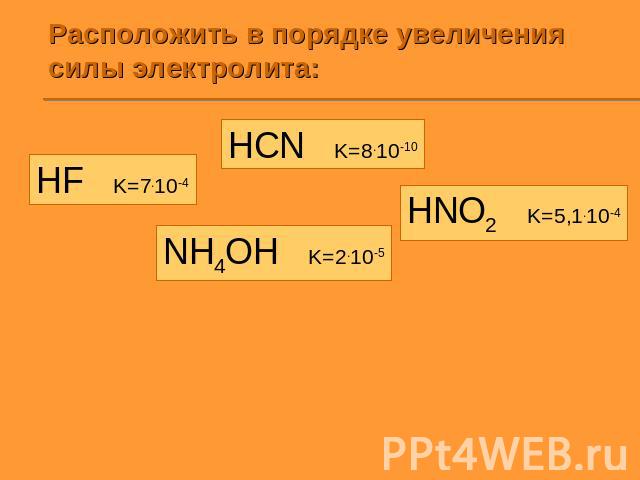
Расположить в порядке увеличения силы электролита:
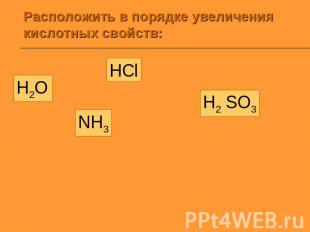
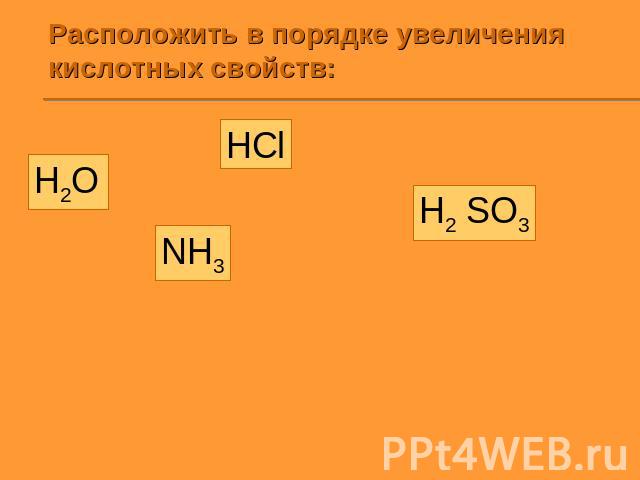
Расположить в порядке увеличения кислотных свойств:

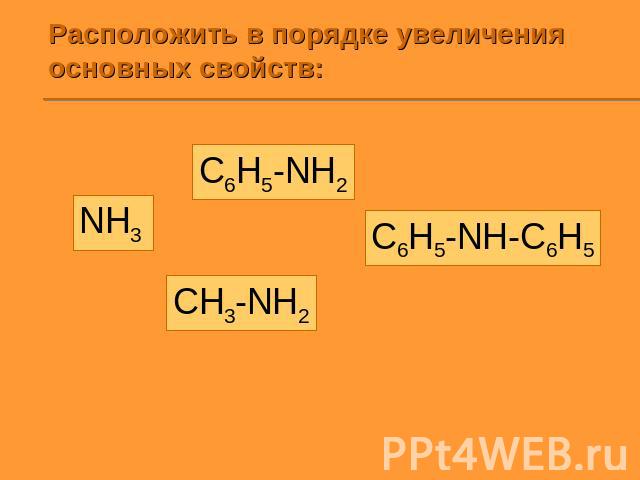
Расположить в порядке увеличения основных свойств:

Укажи, допущены ли ошибки в тексте: 1. На процесс диссоциации влияет растворение или расплавление вещества. 2. Сернистая кислота – слабая, потому что она распадается на сернистый газ и воду. 3. Основность кислоты не всегда совпадает с числом не всегда совпадает с числом атомов водорода в ней. 4. Все щелочи – сильные электролиты. 5. Константа диссоциации вещества по первой ступени всегда больше, чем по второй. 6. Степень диссоциации зависит от температуры и концентрации электролита. 7. Диссоциация электролитов – обратимый процесс. 8. Это реакция ионного обмена: 2КОН+SiO2 = K2SiO3 + H2O. 9. Отражает ли сущность реакции Cu(OH)2 + 2 HCl = CuCl2 + 2H2O сокращенное ионное уравнение: H+ + OH- = H2O. 10. Реакции ионного обмена идут до конца (практически необратимо), если ионы, соединяясь друг с другом, образуют нерастворимые, малодиссоциирующие и газообразные вещества.

Укажи, допущены ли ошибки в тексте: 1. На процесс диссоциации влияет растворение или расплавление вещества. 2. Сернистая кислота – слабая, потому что она распадается на сернистый газ и воду. 3. Основность кислоты не всегда совпадает с числом атомов водорода в ней. 4. Все щелочи – сильные электролиты. 5. Константа диссоциации слабой кислоты по первой ступени всегда больше, чем по второй. 6. Степень диссоциации зависит от температуры и концентрации электролита. 7. Диссоциация электролитов – обратимый процесс. 8. Это реакция ионного обмена: 2КОН+SiO2 = K2SiO3 + H2O. 9. Отражает ли сущность реакции Cu(OH)2 + 2 HCl = CuCl2 + 2H2O сокращенное ионное уравнение: H+ + OH- = H2O. 10. Реакции ионного обмена идут до конца (практически необратимо), если ионы, соединяясь друг с другом, образуют нерастворимые, малодиссоциирующие и газообразные вещества.

Домашнее задание: § 15, стр.148-151 упр. 3, 4, 5