Презентация на тему: Определение качества воды

Определение качества воды

Одним из компонентов строительных растворов и бетонов на основе минеральных вяжущих является вода, которая во многом определяет свойства получаемого композита. Известно, что при низком рН вода обладает высокой коррозионной активностью, а при высоких уровнях (рН>11) вода приобретает характерную мылкость, неприятный запах, способна вызывать раздражение глаз и кожи. Именно поэтому для питьевой и хозяйственно-бытовой воды оптимальным считается уровень рН в диапазоне от 6 до 9. Требования к качеству воды, используемой в строительных нуждах регламентированы ГОСТ 23732-79 «Вода для бетонов и растворов». Для синтеза наноразмерных модификаторов в водной среде или при использовании воды в качестве носителя требования к показателям её качества значительно ужесточаются. Основным показателем качества воды является содержание в ней растворимых солей. Это определяет другие показатели: значение рН, жесткость воды, удельную электрическую проводимость.

Водородный показатель или рН указывает на степень кислотности или степень щелочности раствора. Он отражает концентрацию катионов водорода в воде, так: при [H+] = 10-7 – раствор нейтрален, рН=7; при [H+] > 10-7 – раствор кислый, рН>7; при [H+]

Жесткость воды – показатель, характеризующий содержание ионов кальция и магния в воде. Суммарное содержание этих солей называют общей жесткостью. В зависимости от вида анионов различают карбонатную и некарбонатную жесткость. Карбонатная жесткость указывает на содержание в воде карбонатов магния и кальция, а некарбонатная – других солей кальция и магния (хлоридов, сульфатов и др.). Карбонатную жесткость также называют временной, так как её легко удалить кипячением, при этом протекает реакция:

Высокое содержание в воде солей кальция и магния делает воду непригодной для использования: в такой воде расход многих дорогостоящих добавок для строительных смесей возрастает из-за протекания обменных реакций с образованием нерастворимых солей кальция. Например, при растворении анионных ПАВ в жёсткой воде протекает реакция: 2С17Н35СООNа + СаSО4 → (С17Н35СОО)2Са↓ + Nа2SО4. Существуют различные способы определения жесткости, основными из них являются титриметрический и комплексометрический. При титриметрическом способе образец воды титруют 0,1 н. раствором соляной кислоты в присутствии метилового оранжевого. Титрование прекращают при появлении оранжевой окраски. При этом гидрокарбонаты, обусловливающие временную жесткость, разлагаются согласно реакции: Ca (HCO3)2 + 2Н+→ Ca2+ +2CO2↑+2H2O Комплексонометрически определение жесткости воды проводят титрованием воды 0,05н раствором комплексона III в присутствии индикатора эриохрома черного. Титрование прекращают при переходе красной окраски раствора в синюю.

Методика определения жесткости воды

Методика определения жесткости воды

Проведение расчет жесткости воды

Методы осаждения. При использовании метода осаждения катионы кальция и магния переводят в нерастворимые соединения, которые выпадают в осадок. Это достигается путём кипячения или введением химических реагентов. Использование химических реагентов имеет существенное преимущество перед кипячением, так как позволяет осаждать все соли кальция и магния, то есть снижать как временную, так и постоянную жесткость. Метод ионного обмена. Для снижения жесткости методом ионного обмена используют катионитные колонки – трубки, наполненные катионообменными смолами. При прохождении воды через такую колонку происходит обмен катионов кальция и магния воды на катионы натрия катионита, также возможно очищение воды и от других катионов. Для удаления анионов используют анионообменные смолы, при их использовании протекает обмен аниона из воды на гидроксид-анион из анионита. При последовательном пропускании воды через различные ионообменные смолы (катиониты и аниониты) достигается практически полное обессоливание воды. При достижении равновесия ионообменные смолы перестают умягчать воду, поэтому их регенерируют, пропуская через них концентрированные растворы солей NаСl, NаSО4 или растворы кислот НСl, Н2SО4 – для катионитов и растворы щелочей или соды – для анионитов.

Удельная электрическая проводимость воды или удельная электропроводность – это способность одного кубического сантиметра вещества проводить определенный электрический заряд, это свойство водных растворов обусловлено движением ионов под действием электрического поля. Как любой проводник, раствор электролита обладает определенным сопротивлением. Электропроводность — явление обратное электрическому сопротивлению и измеряется единицами, называемыми [Mо, См]. Удельная электропроводность соответствует электропроводности 1 см3 раствора, находящегося между электродами площадью 1 см2 и на расстоянии 1 см друг от друга [Мо/см; См/см]. Однако для анализа водных систем принято использовать единицу изменения [мкСм/см]. Удельная электрическая проводимость воды зависит от температуры, характера ионов и их концентрации. Обычно удельная электрическая проводимость воды дается для 25°С, так что она зависит только от концентрации и характера растворенных компонентов. Поскольку удельная электрическая проводимость измеряется очень быстро, по ней можно легко определить химический состав воды.

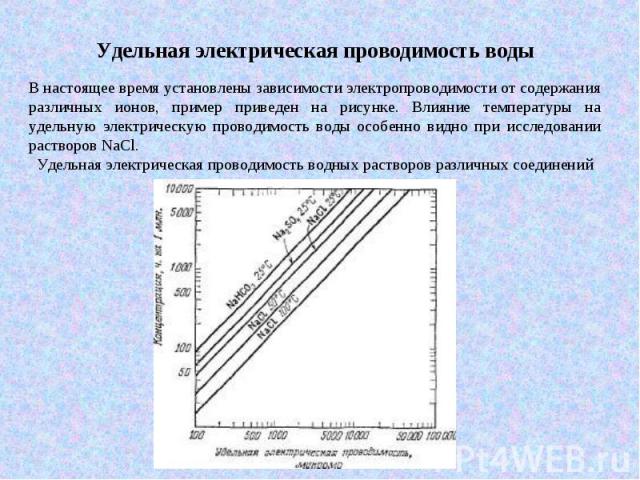
В настоящее время установлены зависимости электропроводимости от содержания различных ионов, пример приведен на рисунке. Влияние температуры на удельную электрическую проводимость воды особенно видно при исследовании растворов NaCl. Удельная электрическая проводимость водных растворов различных соединений

Удельная электрическая проводимость воды Среди распространенных типов природных вод при данной общей минерализации воды, содержащие бикарбонат и сульфат кальция, обычно имеют самую низкую проводимость, а воды, содержащие хлористый натрий, обладают наибольшей проводимостью. Чистая вода имеет удельную электрическую проводимость 0,055 мкМо при 25°C, лабораторная дистиллированная вода – от 0,5 до 5 мкМо, дождевая обычно – от 5 до 30 мкМо, подземная вода, пригодная для питья – от 30 до 2000 мкМо, океаническая – от 45000 до 55000 мкМо, рассолы нефтяных месторождений – более 100000 мкМо.

Хроматографический анализ

Хроматографический анализ

Хроматографический анализ

Хроматографический анализ

Хроматографический анализ

Хроматографический анализ



![Водородный показатель или рН указывает на степень кислотности или степень щелочности раствора. Он отражает концентрацию катионов водорода в воде, так: при [H+] = 10-7 – раствор нейтрален, рН=7; при [H+] > 10-7 – раствор кислый, рН>7; при [H+] Водородный показатель или рН указывает на степень кислотности или степень щелочности раствора. Он отражает концентрацию катионов водорода в воде, так: при [H+] = 10-7 – раствор нейтрален, рН=7; при [H+] > 10-7 – раствор кислый, рН>7; при [H+]](https://fs1.ppt4web.ru/images/95606/146824/640/img2.jpg)