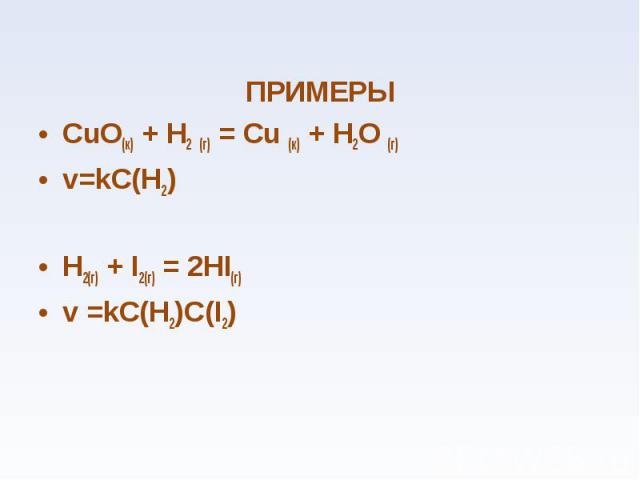Презентация на тему: ТЕРМОДИНАМИКА


Элементы химической термодинамики, термодинамики растворов и химической кинетики Элементы химической термодинамики, термодинамики растворов и химической кинетики Биологически активные низкомолекулярные неорганические и органические вещества (строение, свойства, участие в функционировании живых систем). Основные типы химических равновесий и процессов в функционировании живых систем

4. Физико-химия поверхностных явлений в функционировании живых систем 4. Физико-химия поверхностных явлений в функционировании живых систем 5. Физико-химия дисперсных систем в функционировании живых систем 6. Биологически активные ВМС

1. Попков В.А., Пузаков С.А. Общая химия: Учебник. - М.: ГЭОТАР-Медиа, 2007. -976 с. 1. Попков В.А., Пузаков С.А. Общая химия: Учебник. - М.: ГЭОТАР-Медиа, 2007. -976 с. 2. Пузаков С.А. Сборник задач и упражнений по общей химии: Учеб. пособие/ С.А. Пузаков, В.А. Попков, А.А. Филиппова.- 2-е изд. испр. и доп. - М.: Высшая школа, 2007. -255 с.


http://www.chemlib.ru http://www.chemlib.ru http://www.chem.msu.su http://www.xumuk.ru/ http://www.alhimik.ru/ http://alhimikov.net/ http://chemistry.narod.ru/ http://www.chemport.ru/



1. Основные понятия химической термодинамики 1. Основные понятия химической термодинамики 2. Первое начало термодинамики. Энтальпия. Закон Гесса. 3. Второе начало термодинамики. Энтропия. Изобарно-изотермический потенциал. 4. Третье начало термодинамики. 5. Особенности живых организмов с позиции термодинамики. 6. Химическое равновесие 7. Химическая кинетика и катализ

78 химических элементов входят в состав живых организмов. 78 химических элементов входят в состав живых организмов. 44 элемента составляют лекарственные препараты. Изотопы 38 элементов используются в диагностике и радиотерапии различных заболеваний. Более 70 элементов входят в состав материалов, применяемых для изготовления медицинской аппаратуры, приборов, инструментов, перевязочных средств, искусственной крови, различных протезов, зуботехнических материалов и др.


Задача, стоящая перед медиками в ближайшее время, предупреждать, а не лечить болезни. Чтобы стать высококвалифицированным специалистом нужно помнить высказывание М.В. Ломоносова: «…Медик без довольного познания химии совершенен быть не может… От одной химии уповать можно на исправление недостатков лечебной науки»

Термодинамика - наука, изучающая общие законы взаимного превращения одной формы энергии в другую.




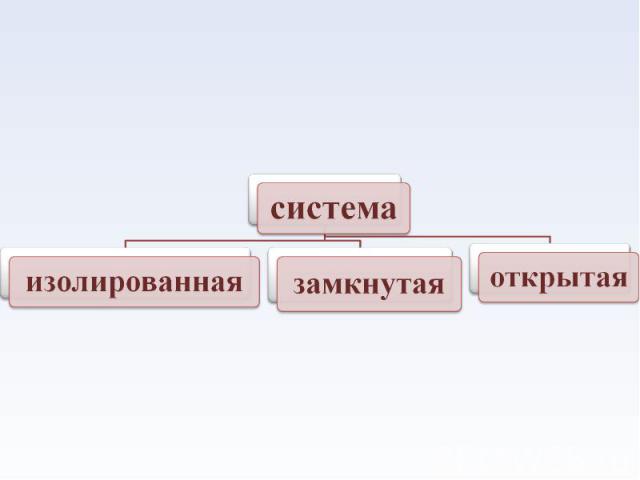
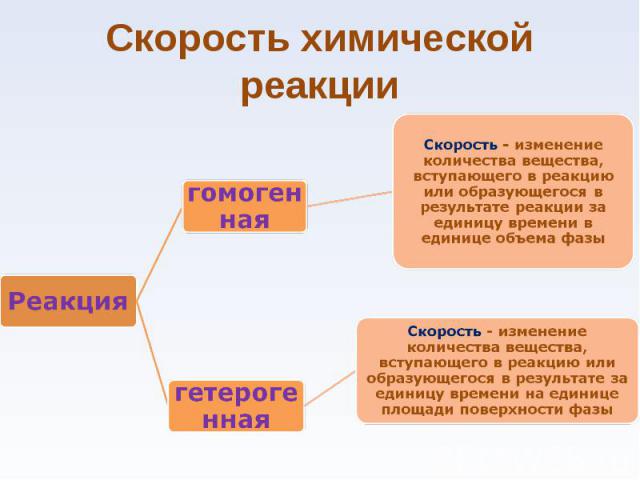
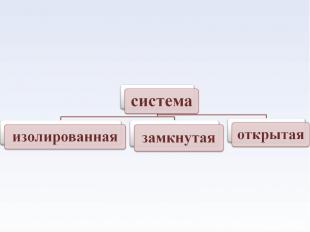
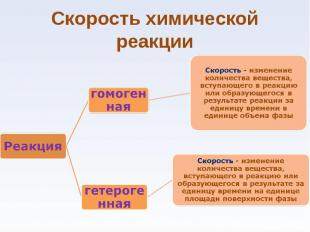
• Гомогенная – система, в которой каждое ее свойство (параметр) имеет одно и то же значение во всех точках объема или меняется плавно от точки к точке. • Гомогенная – система, в которой каждое ее свойство (параметр) имеет одно и то же значение во всех точках объема или меняется плавно от точки к точке. • Гетерогенная –система, которая состоит из нескольких гомогенных систем, отделенных друг от друга поверхностью раздела фаз, на которой свойства меняются скачком.


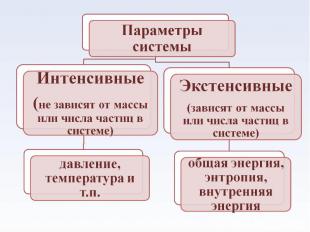
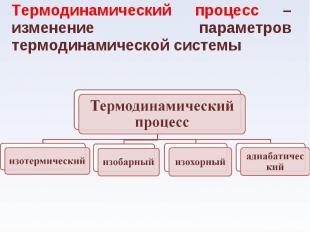
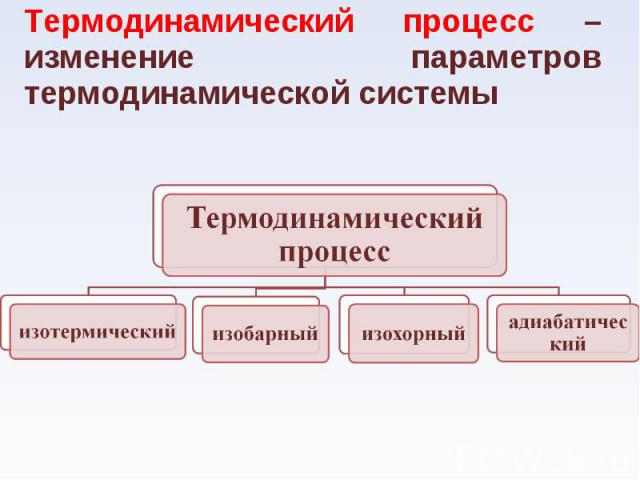
Термодинамический процесс – изменение параметров термодинамической системы Термодинамический процесс – изменение параметров термодинамической системы

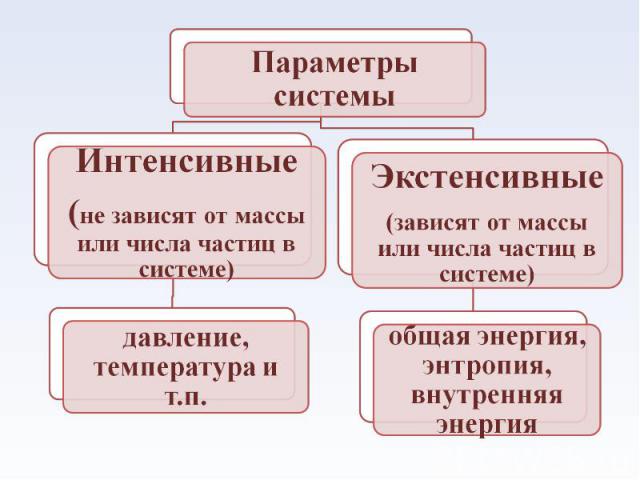
Энергия системы (W) - совокупность двух частей: зависящей от движения и положения системы как целого (Wц) и не зависящей от этих факторов (U) Энергия системы (W) - совокупность двух частей: зависящей от движения и положения системы как целого (Wц) и не зависящей от этих факторов (U) W=Wц+ U U - внутренняя энергия системы.

Внутренняя энергия системы - энергия теплового движения частиц, химическая и ядерная энергия, определяющая поступательное, колебательное и вращательное движение молекул, внутримолекулярное взаимодействие и колебание атомов, энергию вращения электронов Внутренняя энергия системы - энергия теплового движения частиц, химическая и ядерная энергия, определяющая поступательное, колебательное и вращательное движение молекул, внутримолекулярное взаимодействие и колебание атомов, энергию вращения электронов

U = G + Wсв U = G + Wсв Свободная энергия (G) – та часть внутренней энергии, которая может быть использована для совершения работы Связанная энергия (Wсв) – та часть энергии, которую нельзя превратить в работу

термодинамическая система (например, пар в тепловой машине) может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии термодинамическая система (например, пар в тепловой машине) может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии



Для экзотермических реакций Q>0, ΔH<0 Для экзотермических реакций Q>0, ΔH<0 Для эндотермических реакций Q<0, ΔH>0

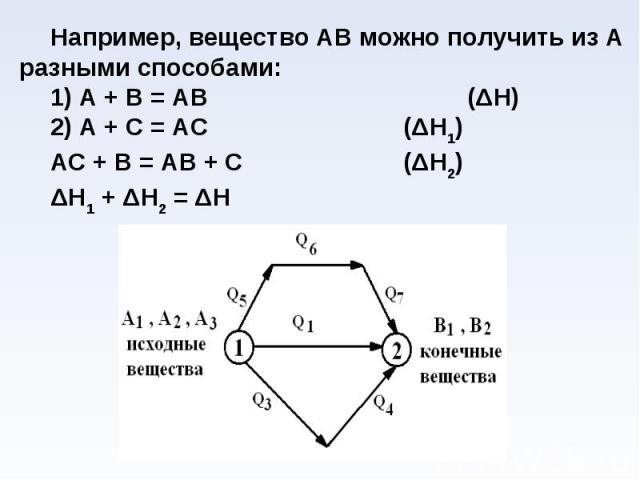
Термохимия – раздел термодинамики, изучающий, теплоты химических реакций Термохимия – раздел термодинамики, изучающий, теплоты химических реакций

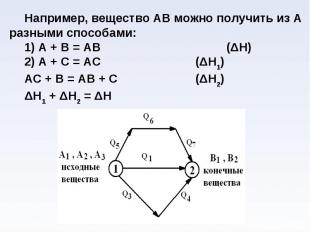


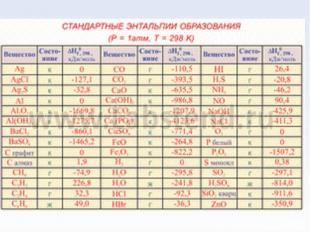






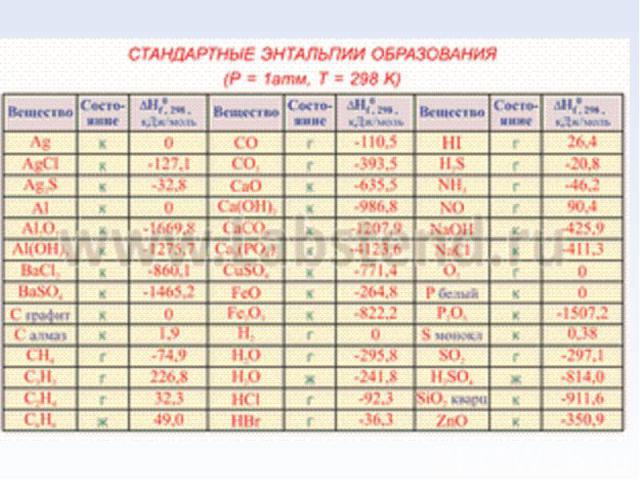
NH4Cl(г) = NH3(г) + HCl(г)↑ NH4Cl(г) = NH3(г) + HCl(г)↑ ΔН0298(реакции) = ΔН0298(HCl) + ΔН0298(NH3) - ΔН0298(NH4Cl) = 176,55 кДж/моль ΔН > 0, р-ция эндотермическая


Постулат Клаузиуса Постулат Клаузиуса Единственным результатом любой совокупности процессов не может быть переход теплоты от менее нагретого тела к более нагретому.







Л. Больцман (1887): высокая упорядоченность имеет относительно низкую вероятность Л. Больцман (1887): высокая упорядоченность имеет относительно низкую вероятность S = k lnP где k — постоянная Больцмана, k = 1.37·10-23 Дж/К. P – статистический вес.

ΔG = ΔH – T · ΔS ΔG = ΔH – T · ΔS где ΔH – изменение энтальпии, Т – абсолютная температура, ΔS – изменение энтропии. Если ΔG <0, процесс протекает самопроизвольно , если ΔG > 0, то процесс невозможен.

В. Нернст (1906) (тепловой закон Нернста): энтропия S любой системы стремится к конечному для неё пределу, не зависящему от давления, плотности или фазы, при стремлении температуры (Т) к абсолютному нулю В. Нернст (1906) (тепловой закон Нернста): энтропия S любой системы стремится к конечному для неё пределу, не зависящему от давления, плотности или фазы, при стремлении температуры (Т) к абсолютному нулю

«Все и только живые системы никогда не бывают в равновесии и исполняют за счет своей свободной энергии постоянную работу против равновесия, требуемого законами физики и химии при существующих внешних условиях» «Все и только живые системы никогда не бывают в равновесии и исполняют за счет своей свободной энергии постоянную работу против равновесия, требуемого законами физики и химии при существующих внешних условиях»

Особенности живых организмов с позиции термодинамики Особенности живых организмов с позиции термодинамики 1.Живой организм – открытая система, непрерывно обменивающаяся с окружающей средой и веществом и энергией. 2. Приложение второго закона т/д-ки к живым системам немыслимо без учета влияния биологических закономерностей. Характер изменения энтропии, имеющий решающее значение в неживых системах, в случае биологических систем имеет лишь подчиненное значение.



Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости прямой и обратной реакций равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости прямой и обратной реакций равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем

Термодинамически химическое равновесие определяется как соотношение концентраций исходных веществ и продуктов реакции, при котором энтропия системы имеет максимальное, а изобарно-изотермический потенциал – минимальное значение Термодинамически химическое равновесие определяется как соотношение концентраций исходных веществ и продуктов реакции, при котором энтропия системы имеет максимальное, а изобарно-изотермический потенциал – минимальное значение

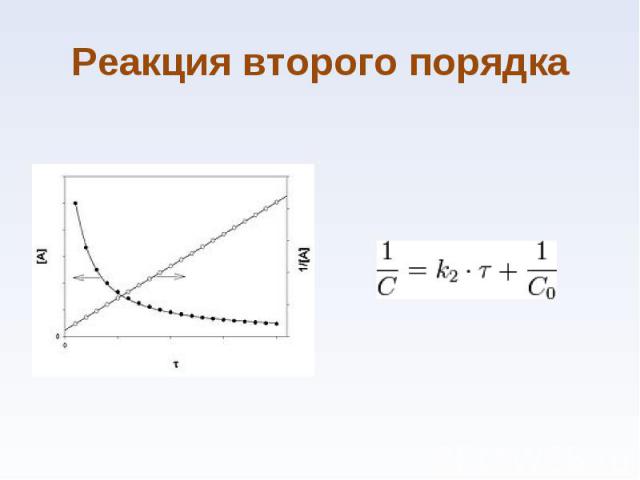
Константа химического равновесия Константа химического равновесия mA + nB ↔ pC + qD v1= k1 ·CАm ·CBn v2=k2 ·CCp ·CDq v1=v2 k1 ·CАm ·CBn = k2 ·CCp ·CDq k1 / k2 = CCp ·CDq/ CАm ·CBn Kp= CCp ·CDq/ CАm ·CBn








1. Основные понятия химической кинетики 1. Основные понятия химической кинетики 2. Факторы, влияющие на скорость химической реакции а) Закон действующих масс. Молекулярность и порядок реакций б) Зависимость скорости реакции от температуры. Энергия активации в) Катализ

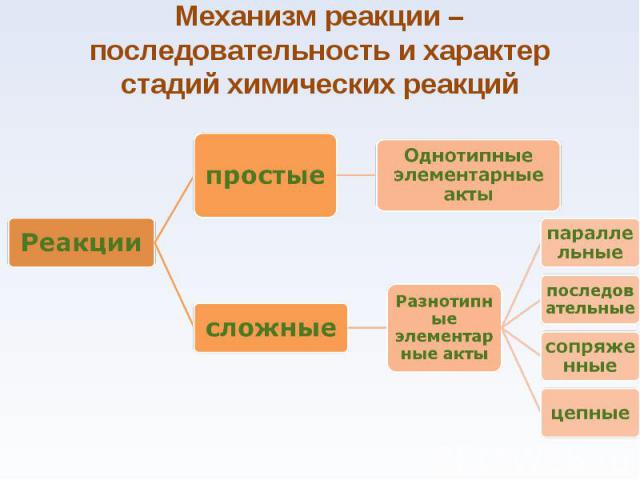
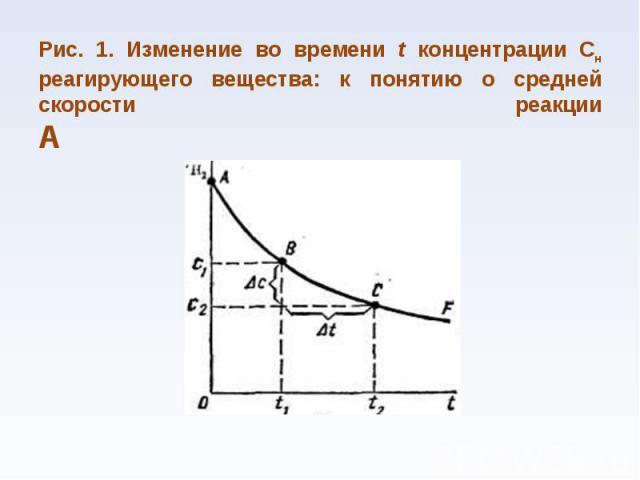
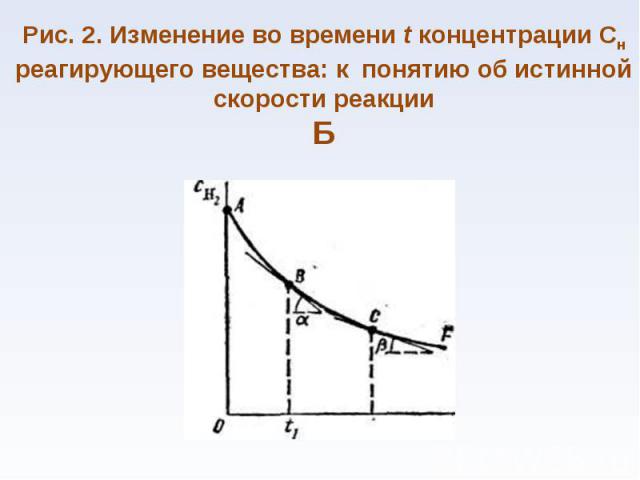
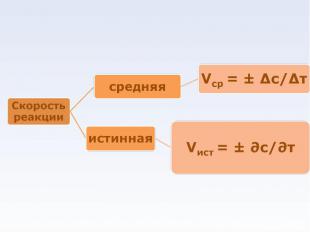
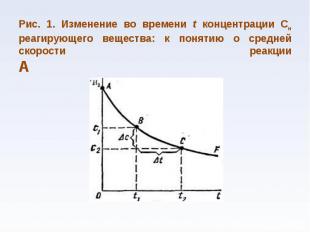
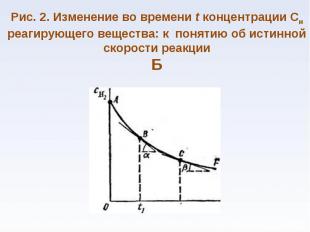
Химическая кинетика занимается исследованием механизмов реакций и течения их во времени Химическая кинетика занимается исследованием механизмов реакций и течения их во времени
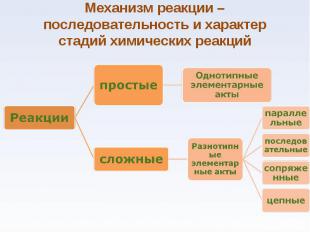

Природа реагирующих веществ Концентрация реагирующих веществ Температура Присутствие катализаторов

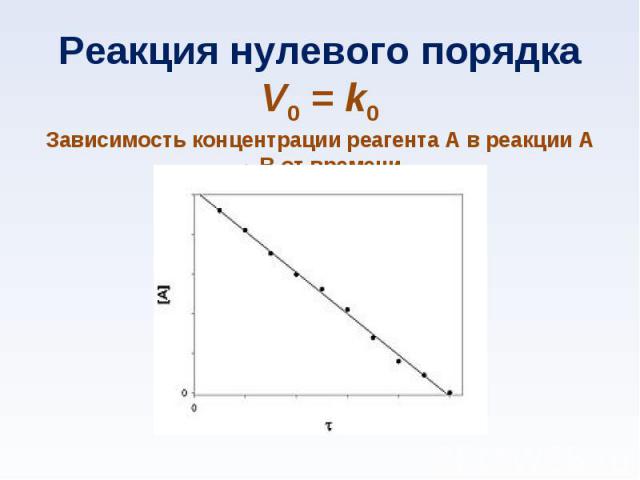
при постоянной температуре скорость химической реакции прямо пропорциональна концентрации реагирующих веществ при постоянной температуре скорость химической реакции прямо пропорциональна концентрации реагирующих веществ nА + mВ → gD v=k CА n CВ m

Константа скорости k не зависит от концентраций веществ Константа скорости k не зависит от концентраций веществ Закон действующих масс применим только к газообразным и растворенным веществам

Молекулярность реакции - число молекул, участвующих в элементарном акте химического взаимодействия Порядок реакции — это сумма показателей степеней концентрации веществ в уравнении закона действующих масс
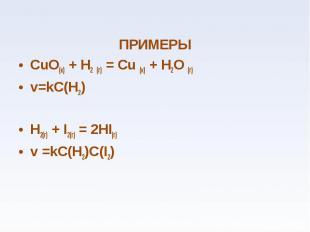
ПРИМЕРЫ ПРИМЕРЫ СuО(к) + Н2 (г) = Сu (к) + Н2О (г) v=kC(H2) H2(г) + I2(г) = 2HI(г) v =kC(H2)C(I2)
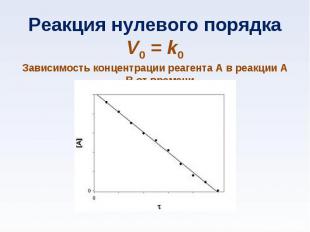

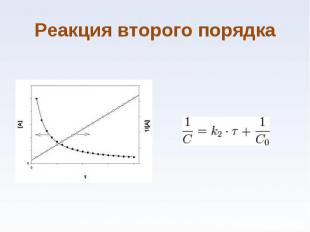


при повышении температуры на каждые 10° скорость реакции увеличивается примерно в 2—4 раза




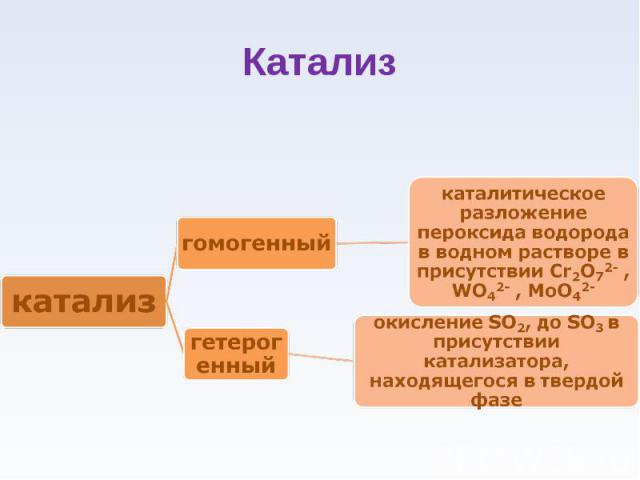
Катализ - процесс увеличения скорости реакции с помощью катализатора Катализ - процесс увеличения скорости реакции с помощью катализатора Катализаторы - вещества, которые увеличивают скорость химической реакции, оставаясь в конечном итоге неизменными по химическому составу и количеству

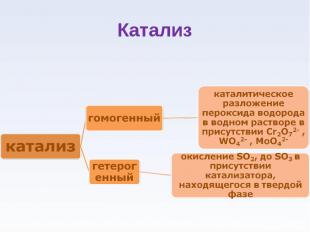

А+В К АВ А+В К АВ A + K = AK AK + B = AB + K

Ферменты – биологические катализаторы, ускоряющие биохимические реакции в растениях и животных организмах Ферменты – биологические катализаторы, ускоряющие биохимические реакции в растениях и животных организмах