Презентация на тему: ДИСПЕРСТНЫЕ СИСТЕМЫ


Дисперсные системы – системы, состоящие из частиц одной фазы, распределенных в другой Дисперсные системы – системы, состоящие из частиц одной фазы, распределенных в другой Диспергирование – процесс измельчения вещества одной фазы в другой Дисперсная фаза – фаза, состоящая из частиц раздробленного вещества Дисперсионная среда – среда, в которой распределены частицы

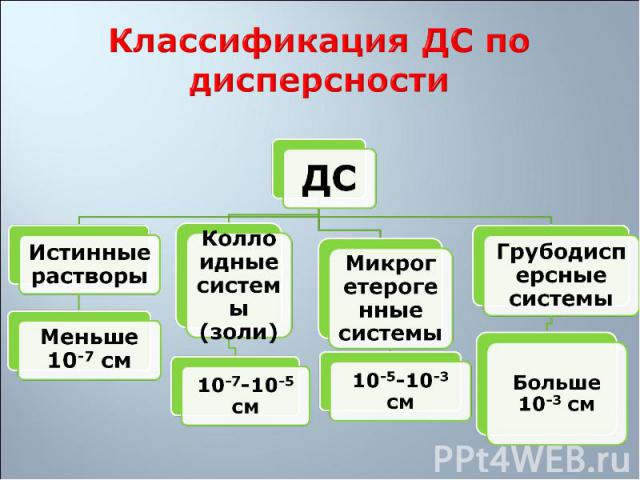
1. Гетерогенность 1. Гетерогенность 2. Дисперсность С уменьшением размера частиц при дроблении вещества увеличивается дисперсность, удельная поверхность, и, как следствие, уменьшается термодинамическая устойчивость системы






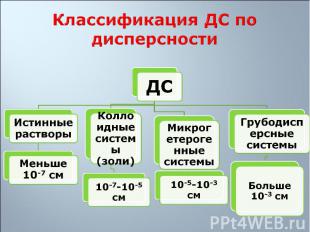
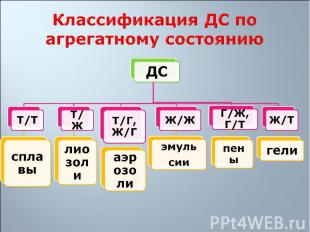

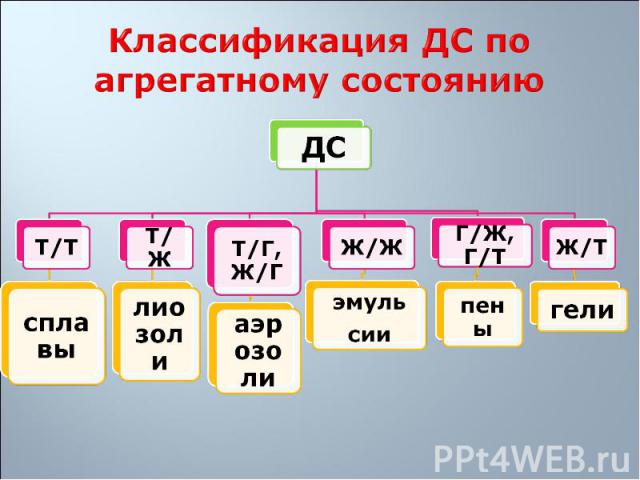
1. Свободнодисперсные: частицы дисперсной фазы не связаны друг с другом, находятся на большом расстоянии одна от другой и могут свободно перемещаться в дисперсионной среде 1. Свободнодисперсные: частицы дисперсной фазы не связаны друг с другом, находятся на большом расстоянии одна от другой и могут свободно перемещаться в дисперсионной среде 2. Связнодисперсные: частицы дисперсной фазы связаны друг с другом межмолекулярными силами и не способны к взаимному перемещению

Переход коллоидной системы из свободнодисперсного состояния в связнодисперсное – гелеобразование, образующиеся при этом структурированные коллоидные системы – гели. Переход коллоидной системы из свободнодисперсного состояния в связнодисперсное – гелеобразование, образующиеся при этом структурированные коллоидные системы – гели. Перевод геля в золь при добавлении электролита-стабилизатора - пептизация

1. Лиофобные – слабое взаимодействие вещества дисперсной фазы со средой (лиозоли, аэрозоли, эмульсии, пены) 1. Лиофобные – слабое взаимодействие вещества дисперсной фазы со средой (лиозоли, аэрозоли, эмульсии, пены) 2. Лиофильные – сильное межмолекулярное взаимодействие веществ фазы и среды с образованием сольватных оболочек из молекул вещества дисперсионной среды (мыла, глины)

Признаки Признаки 1. Размер частиц дисперсной фазы от 2. Гетерогенность 3. Многокомпонентность

Общие условия получения Общие условия получения 1. Нерастворимость вещества дисперсной фазы в дисперсионной среде 2. Достижение коллоидной степени дисперсности частицами дисперсной фазы 3. Наличие третьего компонента-стабилизатора, который препятствует агрегации частиц и сообщает коллоидной системе агрегативную устойчивость

1. Диспергирование – дробление крупных частиц грубодисперсных систем до коллоидной степени дисперсности 1. Диспергирование – дробление крупных частиц грубодисперсных систем до коллоидной степени дисперсности 2. Конденсация – соединение атомов, ионов или ионов истинного раствора в агрегаты коллоидных размеров

1. Механическое – раздавливание, дробление, растирание крупных частиц суспензий, эмульсий, порошков 1. Механическое – раздавливание, дробление, растирание крупных частиц суспензий, эмульсий, порошков 2. Ультразвуковое 3. Электрическое 4. Пептизация

1. Конденсация паров 1. Конденсация паров 2. Замена растворителя 3. Различные химические реакции

Диализ, Диализ, электродиализ, ультрафильтрация Основаны на способности молекул разных размеров или ионов проходить через полупроницаемые мембраны. Крупные частицы золей через полупроницаемые мембраны пройти не могут






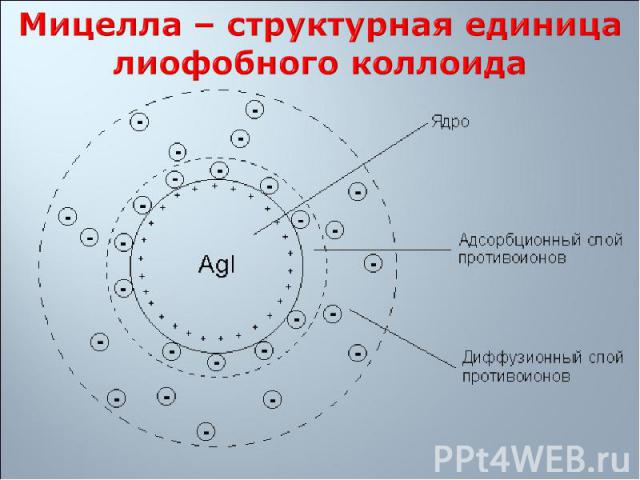
Твердая фаза Твердая фаза Потенциалобразующие ионы Адсорбционный слой противоионов (слой по Гельмгольцу) Диффузный слой противоионов (слой по Гуи)
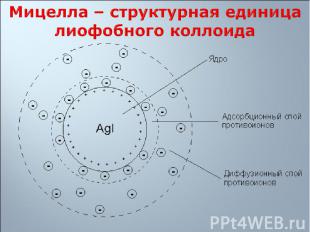

на поверхности ядра мицеллы адсорбируются ионы, имеющиеся в составе ядра, т.е. адсорбируются ионы, находящиеся в избытке на поверхности ядра мицеллы адсорбируются ионы, имеющиеся в составе ядра, т.е. адсорбируются ионы, находящиеся в избытке
![{m [AgI]nI־ (n – x)K+}x־ г р &nb {m [AgI]nI־ (n – x)K+}x־ г р &nb](https://fs1.ppt4web.ru/images/95239/124835/310/img28.jpg)
{m [AgI]nI־ (n – x)K+}x־ г р а н у л а {m [AgI]nI־ (n - x)K+}x־xK+ м и ц е л л а
![{m[AgI]nAg+(n- x)NO3 ־}x+xNO3־ {m[AgI]nAg+(n- x)NO3 ־}x+xNO3־ & {m[AgI]nAg+(n- x)NO3 ־}x+xNO3־ {m[AgI]nAg+(n- x)NO3 ־}x+xNO3־ &](https://fs1.ppt4web.ru/images/95239/124835/310/img29.jpg)
{m[AgI]nAg+(n- x)NO3 ־}x+xNO3־ {m[AgI]nAg+(n- x)NO3 ־}x+xNO3־ (гранула положительна) {m[AgI]nI ־(n- x)K+}x־xK+ (гранула отрицательна)










Порог коагуляции обратно пропорционален шестой степени электрического заряда ионов-коагуляторов Порог коагуляции обратно пропорционален шестой степени электрического заряда ионов-коагуляторов γс = k/Z6, k – коэффициент. То есть, значения порогов коагуляции для одно-, двух-, и трехвалентных ионов как 1 : (1/2)6 : (1/3)6 = 1 : 1/64 : 1/729 = 729 : 11: 1.

Порог коагуляции зависит от природы электролита и от валентности коагулирующего иона и вычисляют по формуле: Порог коагуляции зависит от природы электролита и от валентности коагулирующего иона и вычисляют по формуле: γ = СV(электролита)/(V(золя) + V(электролита)) (ммоль/л), где С – концентрация электролита, ммоль/л; V - минимальный объем раствора электролита, при добавлении которого началась коагуляция золя, мл.















СПАСИБО ЗА ВНИМАНИЕ СПАСИБО ЗА ВНИМАНИЕ


























![{m [AgI]nI־ (n – x)K+}x־ г р а н у л а {m [AgI]nI־ (n - x)K+}x־xK+ м и &n… {m [AgI]nI־ (n – x)K+}x־ г р а н у л а {m [AgI]nI־ (n - x)K+}x־xK+ м и &n…](https://fs1.ppt4web.ru/images/95239/124835/640/img28.jpg)
![{m[AgI]nAg+(n- x)NO3 ־}x+xNO3־ {m[AgI]nAg+(n- x)NO3 ־}x+xNO3־ (гранула положительна) {m[AgI]nI ־(n- x)K+}x־xK+ (гранула отрицательна) {m[AgI]nAg+(n- x)NO3 ־}x+xNO3־ {m[AgI]nAg+(n- x)NO3 ־}x+xNO3־ (гранула положительна) {m[AgI]nI ־(n- x)K+}x־xK+ (гранула отрицательна)](https://fs1.ppt4web.ru/images/95239/124835/640/img29.jpg)





































