Презентация на тему: Строение твердого вещества


ПЛАН Свойства твердого состояния вещества. Строение кристаллов. Типы кристаллических решеток. Упаковка атомов в кристаллах. Аморфное состояние вещества.

Твердое тело сохраняет и свою форму и свой объем, т.к. молекулы или атомы в кристаллах не могут передвигаться на большие расстояния, а только совершают колебательное движение в узлах кристаллической решетки

кристаллические вещества состоят из огромного количества очень маленьких кристалликов, имеющих абсолютно одинаковое строение. кристаллические вещества характеризуются повторяющимся в пространстве расположением атомов или ионов, образующих правильные геометрические тела (куб, параллелепипед, призма и др.)

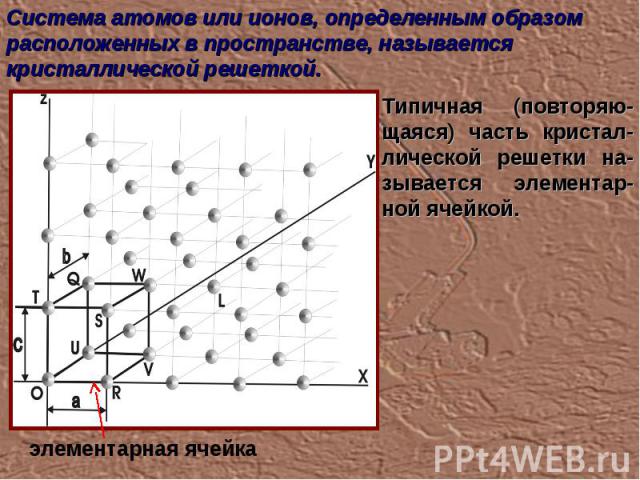
Система атомов или ионов, определенным образом расположенных в пространстве, называется кристаллической решеткой. Типичная (повторяю-щаяся) часть кристал-лической решетки на-зывается элементар-ной ячейкой. элементарная ячейка
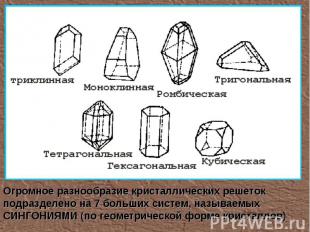
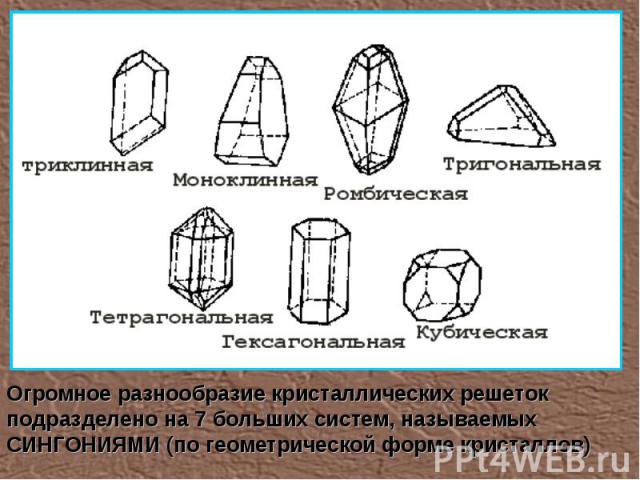
Огромное разнообразие кристаллических решеток подразделено на 7 больших систем, называемых СИНГОНИЯМИ (по геометрической форме кристаллов)
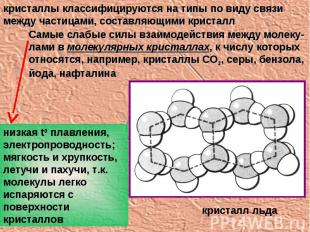
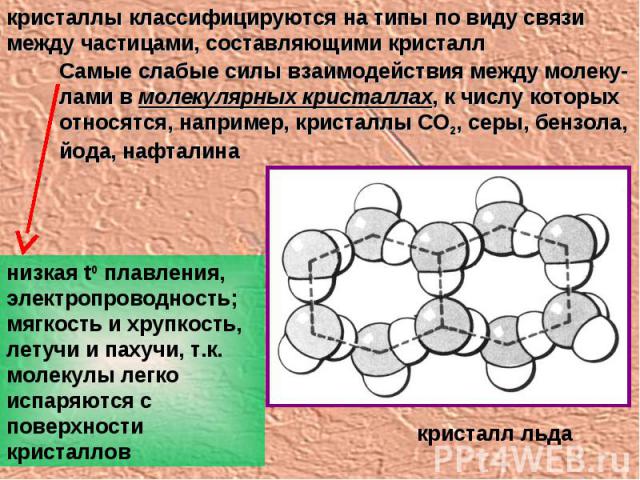
кристаллы классифицируются на типы по виду связи между частицами, составляющими кристалл Самые слабые силы взаимодействия между молеку-лами в молекулярных кристаллах, к числу которых относятся, например, кристаллы СО2, серы, бензола, йода, нафталина низкая t0 плавления, электропроводность; мягкость и хрупкость, летучи и пахучи, т.к. молекулы легко испаряются с поверхности кристаллов кристалл льда
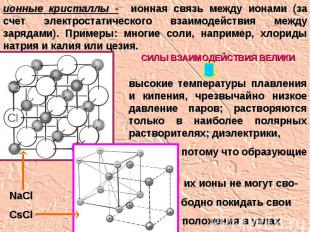
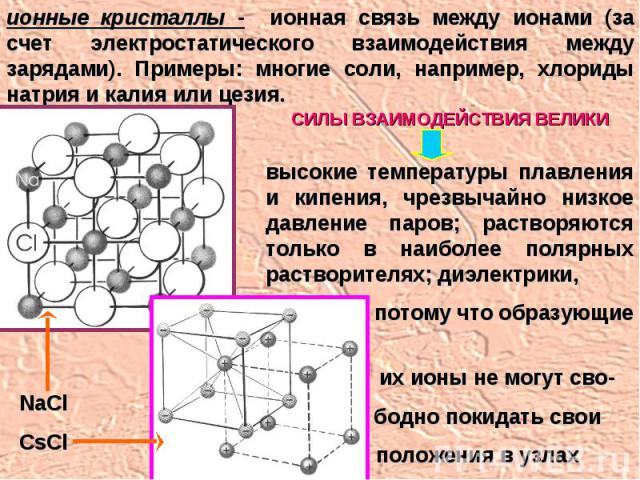
ионные кристаллы - ионная связь между ионами (за счет электростатического взаимодействия между зарядами). Примеры: многие соли, например, хлориды натрия и калия или цезия. высокие температуры плавления и кипения, чрезвычайно низкое давление паров; растворяются только в наиболее полярных растворителях; диэлектрики, потому что образующие их ионы не могут сво- бодно покидать свои положения в узлах решетки СИЛЫ ВЗАИМОДЕЙСТВИЯ ВЕЛИКИ NaClCsCl
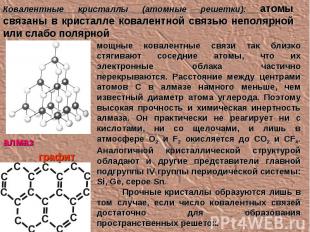
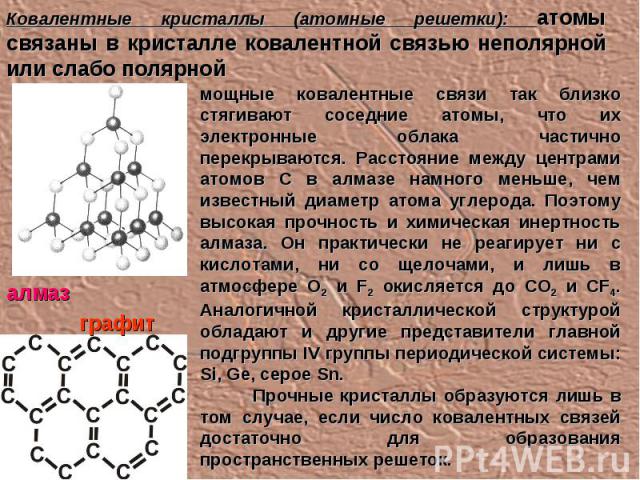
Ковалентные кристаллы (атомные решетки): атомы связаны в кристалле ковалентной связью неполярной или слабо полярной мощные ковалентные связи так близко стягивают соседние атомы, что их электронные облака частично перекрываются. Расстояние между центрами атомов С в алмазе намного меньше, чем известный диаметр атома углерода. Поэтому высокая прочность и химическая инертность алмаза. Он практически не реагирует ни с кислотами, ни со щелочами, и лишь в атмосфере О2 и F2 окисляется до CO2 и CF4. Аналогичной кристаллической структурой обладают и другие представители главной подгруппы IV группы периодической системы: Si, Ge, серое Sn. Прочные кристаллы образуются лишь в том случае, если число ковалентных связей достаточно для образования пространственных решеток. алмаз графит
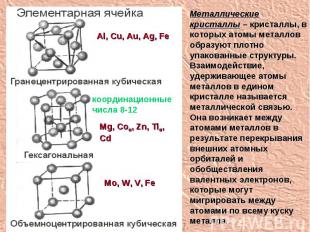
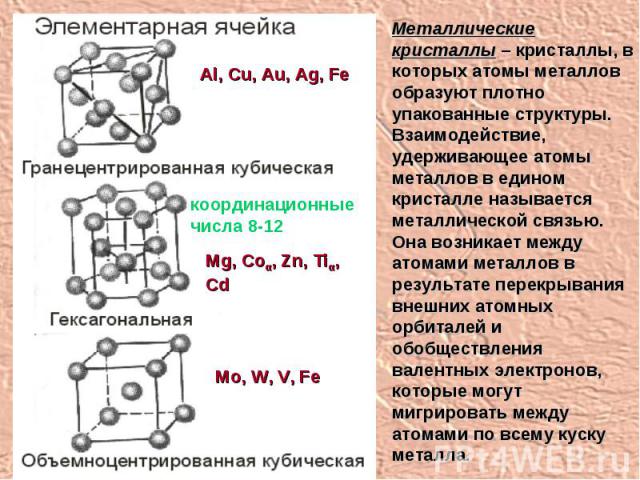
Металлические кристаллы – кристаллы, в которых атомы металлов образуют плотно упакованные структуры. Взаимодействие, удерживающее атомы металлов в едином кристалле называется металлической связью. Она возникает между атомами металлов в результате перекрывания внешних атомных орбиталей и обобществления валентных электронов, которые могут мигрировать между атомами по всему куску металла. координационные числа 8-12 Al, Cu, Au, Ag, Fe Mg, Coα, Zn, Tiα, Cd Mo, W, V, Fe

Взаимосвязь между положением металлов в ПСЭ и их кристаллическим строением
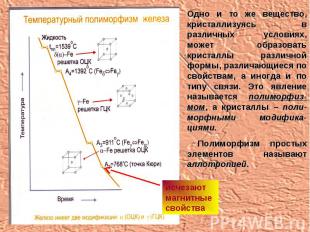
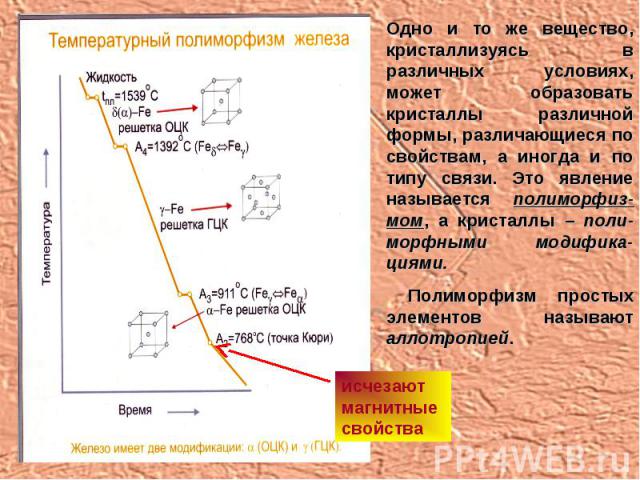
Одно и то же вещество, кристаллизуясь в различных условиях, может образовать кристаллы различной формы, различающиеся по свойствам, а иногда и по типу связи. Это явление называется полиморфиз-мом, а кристаллы – поли-морфными модифика-циями. Полиморфизм простых элементов называют аллотропией. исчезают магнитные свойства
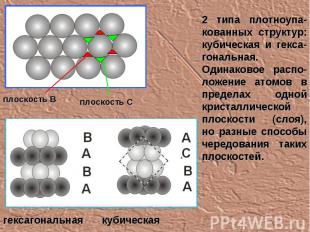
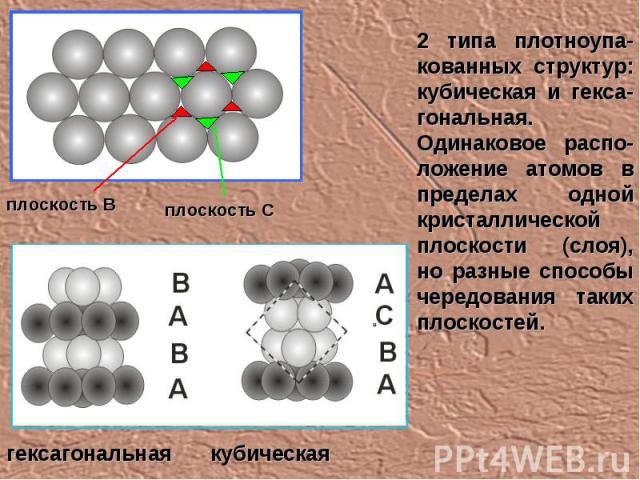
2 типа плотноупа-кованных структур: кубическая и гекса-гональная. Одинаковое распо-ложение атомов в пределах одной кристаллической плоскости (слоя), но разные способы чередования таких плоскостей. плоскость В плоскость С гексагональная кубическая
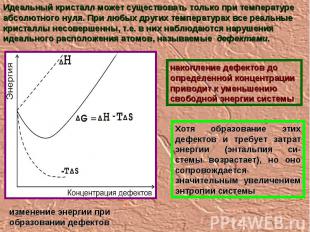
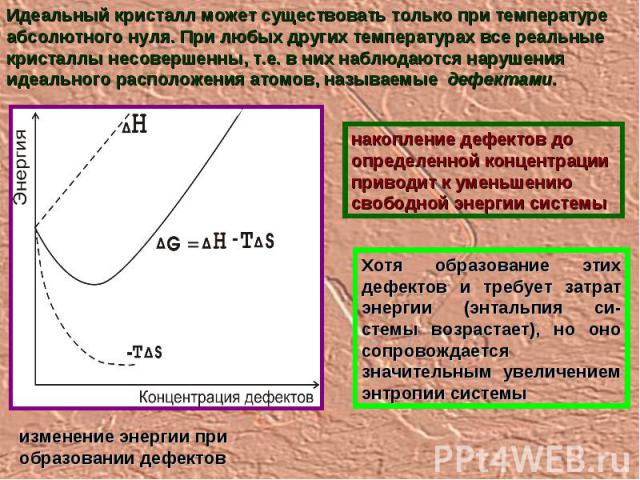
Идеальный кристалл может существовать только при температуре абсолютного нуля. При любых других температурах все реальные кристаллы несовершенны, т.е. в них наблюдаются нарушения идеального расположения атомов, называемые дефектами. накопление дефектов до определенной концентрации приводит к уменьшению свободной энергии системы Хотя образование этих дефектов и требует затрат энергии (энтальпия си-стемы возрастает), но оно сопровождается значительным увеличением энтропии системы изменение энергии при образовании дефектов
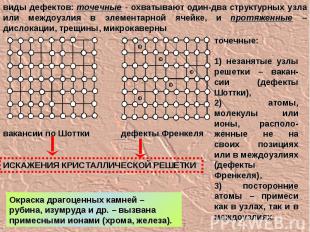
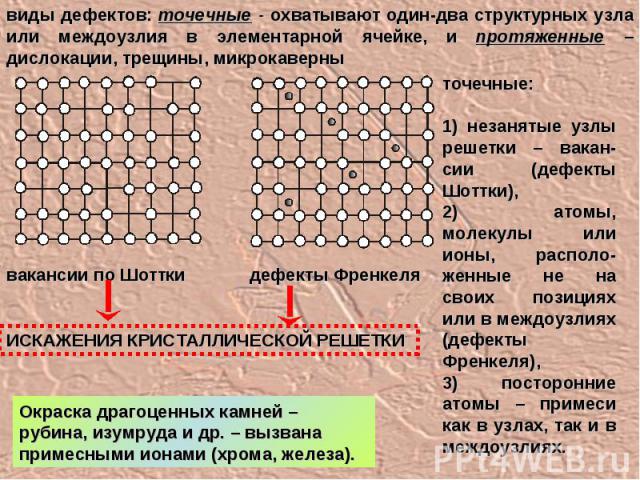
виды дефектов: точечные - охватывают один-два структурных узла или междоузлия в элементарной ячейке, и протяженные – дислокации, трещины, микрокаверны точечные: 1) незанятые узлы решетки – вакан-сии (дефекты Шоттки), 2) атомы, молекулы или ионы, располо-женные не на своих позициях или в междоузлиях (дефекты Френкеля), 3) посторонние атомы – примеси как в узлах, так и в междоузлиях. вакансии по Шоттки дефекты Френкеля Окраска драгоценных камней – рубина, изумруда и др. – вызвана примесными ионами (хрома, железа). ИСКАЖЕНИЯ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
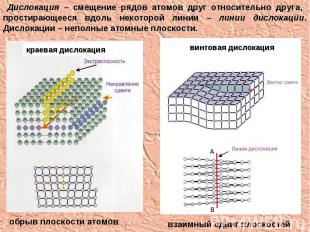
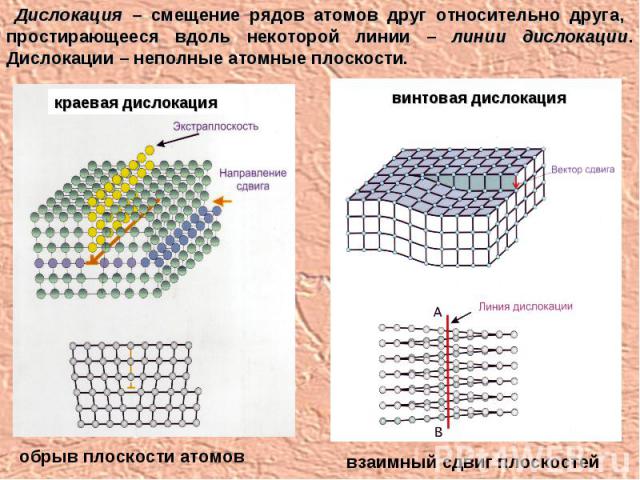
Дислокация – смещение рядов атомов друг относительно друга, простирающееся вдоль некоторой линии – линии дислокации. Дислокации – неполные атомные плоскости. обрыв плоскости атомов взаимный сдвиг плоскостей краевая дислокация винтовая дислокация
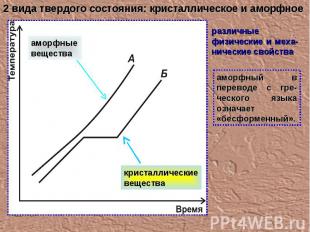
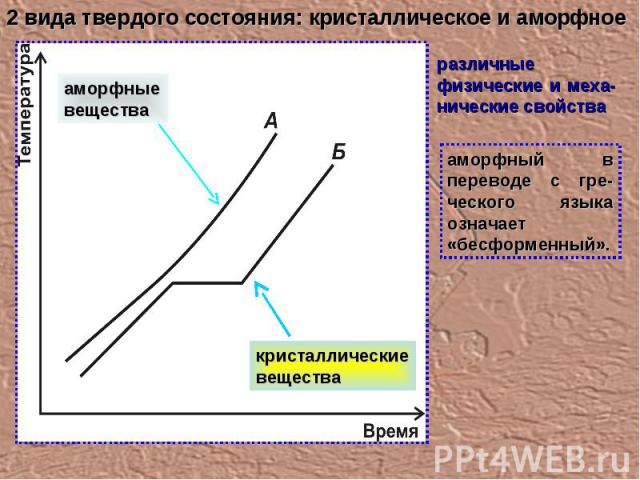
аморфный в переводе с гре-ческого языка означает «бесформенный». 2 вида твердого состояния: кристаллическое и аморфное различные физические и меха-нические свойства аморфные вещества кристаллические вещества
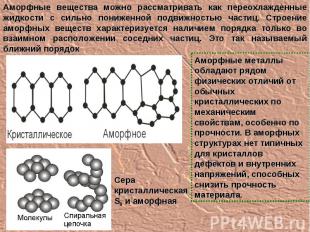
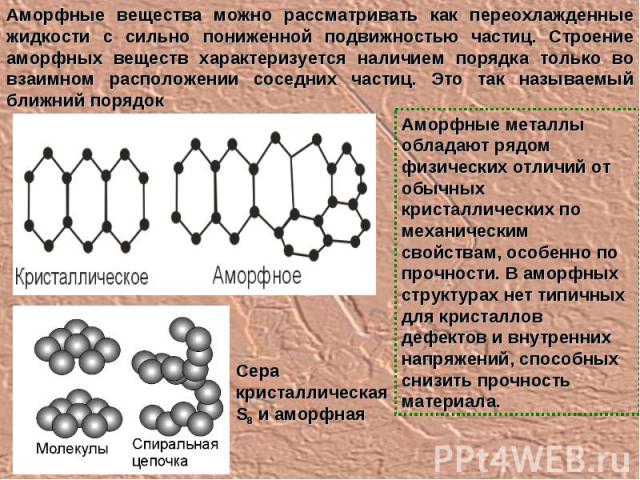
Аморфные вещества можно рассматривать как переохлажденные жидкости с сильно пониженной подвижностью частиц. Строение аморфных веществ характеризуется наличием порядка только во взаимном расположении соседних частиц. Это так называемый ближний порядок Сера кристаллическая S8 и аморфная Аморфные металлы обладают рядом физических отличий от обычных кристаллических по механическим свойствам, особенно по прочности. В аморфных структурах нет типичных для кристаллов дефектов и внутренних напряжений, способных снизить прочность материала.