Презентация на тему: Строение атома и атомного ядра

Строение атома МУ №3, г.Москва 900igr.net

Цели: Изучить строение атома Закрепить умение составлять электронно-графические, электронно-волновые модели атома Закрепить умение записывать электронные формулы атомов 2

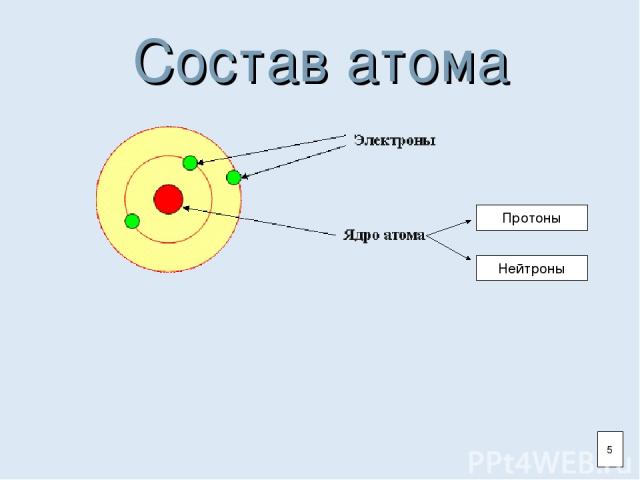
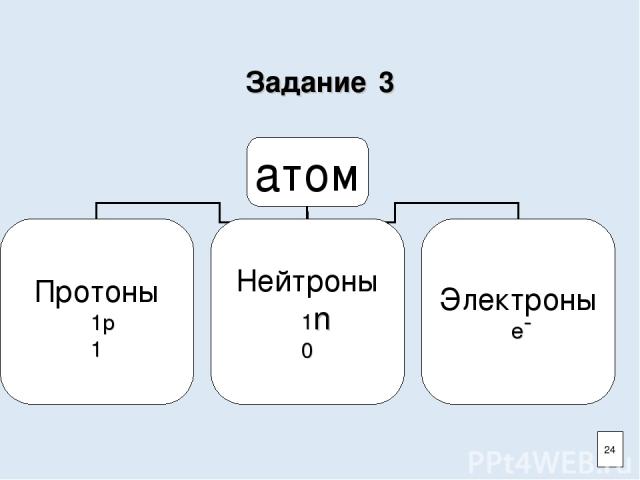
Атом и ядро Атом- наименьшая электронейтральная частица химического элемента. Атом состоит из ядра и электронной оболочки. Ядро состоит из протонов и нейтронов. 3
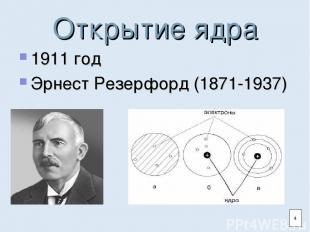
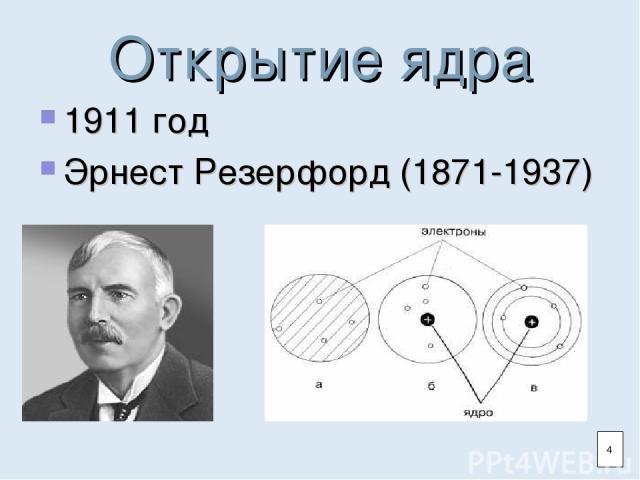
Открытие ядра 1911 год Эрнест Резерфорд (1871-1937) 4
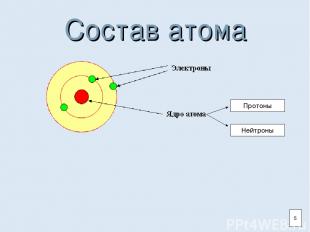
Состав атома Протоны Нейтроны 5

Расчёт числа протонов, нейтронов и электронов ma =m1p+m1n 1 0 1p=Zя=№элемента 1 e¯=1p=Zя=№элемента 1 1n =ma - m1p 0 1 6

Пример: Элемент калий (№ 19) ma = 39 а.е.m. 1p=19 1 1n =ma - m1p=39-19=20 0 1 e¯=19 7

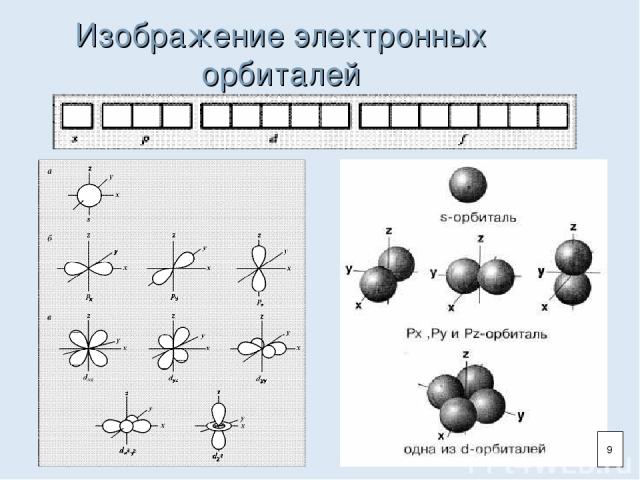
Нахождение электрона в атоме Орбиталь - область пространства вокруг ядра атома, где наиболее вероятно нахождение электрона. На одной орбитали может находиться не более двух электронов. 8
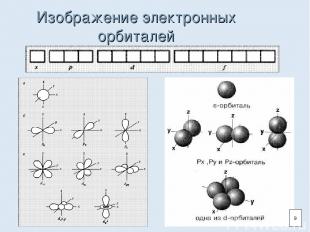
Изображение электронных орбиталей 9

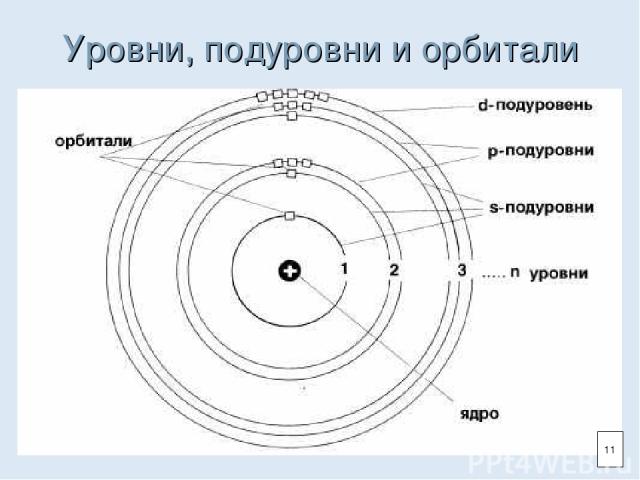
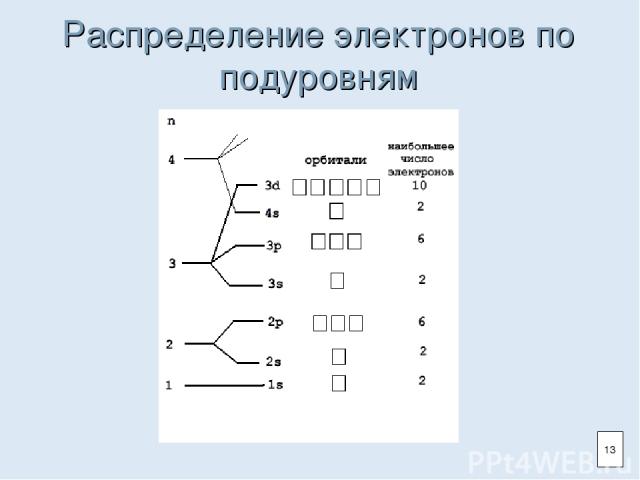
Энергетический уровень (электронный слой) Энергетический уровень (1,2,3…)-характеризует энергию связи электрона с ядром. На одном уровне располагаются электроны, имеющие орбитали разной формы, но с близким по величине запасом энергии. Внутри энергетического уровня в зависимости от формы орбиталей различают подуровни (s, p, d, f). 10
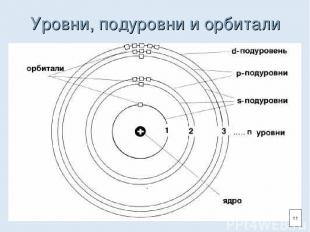
Уровни, подуровни и орбитали 11

Правила распределения электронов на энергетическом уровне Максимальное число электронов на энергетическом уровне рассчитывается по формуле: N=2n² (n-порядковый номер энергетического уровня). Например, 1-ый уровень (n=1) – 2 электрона, 2-ой уровень (n=2) – 8 электронов и т.д. На внешнем энергетическом уровне может располагаться не более 8 электронов. 12
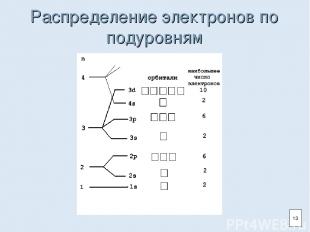
Распределение электронов по подуровням 13
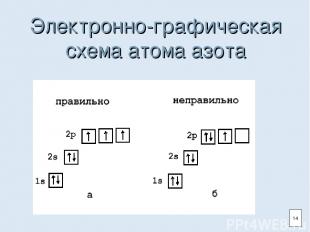
Электронно-графическая схема атома азота 14

Электронная формула атома азота 15
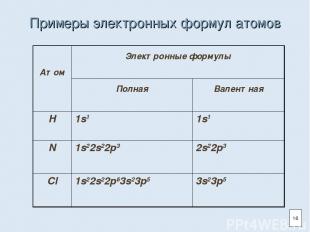
Примеры электронных формул атомов 16 Атом Электронные формулы Полная Валентная H 1s1 1s1 N 1s22s22p3 2s22p3 Cl 1s22s22p63s23p5 3s23p5

Контролирующие материалы Выполните задания из данного раздела Проверьте правильность выполнения заданий Поставьте себе оценку за работу 17

Атом - это наименьшая … частица химического элемента. Атом состоит из … и … оболочки. 3. … состоит из протонов и нейтронов. 4. В 1911 г. английский ученый … доказал, что в центре атома имеется … заряженное ядро. 5. В состав атомного ядра входят … и … 6. Число электронов, движущихся вокруг ядра атома, равно … … элемента. 7. Порядковый номер химического элемента совпадает с … … его атома. 8. Электроны, которые обладают наименьшим запасом энергии, находятся на первом … уровне. 9. Число энергетических уровней у элементов определяется по номеру … 10.На одной орбитали может располагаться только …электрона. Задание 1 Вставьте пропущенные слова: 18

Задание 2 Выберите правильный ответ: 1. Количество электронов у атома углерода равно: А) 6 Б) 12 В) 7 Г) 0 2. Количество нейтронов у атома калия равно: А) 39 Б) 20 В) 19 Г) 59 3. Масса атома равна сумме масс: А) нейтронов Б) электронов В) протонов Г) протонов и нейтронов 4. Максимальное число электронов, которые могут находиться на одной орбитали: А) 1 Б) 3 В) 2 Г) 0 5. Число электронов на внешнем энергетическом уровне у атома азота: А) 5 Б) 2 В) 7 Г) 14 6. S-орбитали имеют форму: А) правильной восьмерки Б) шара В) неправильной восьмерки Г) квадрата 19
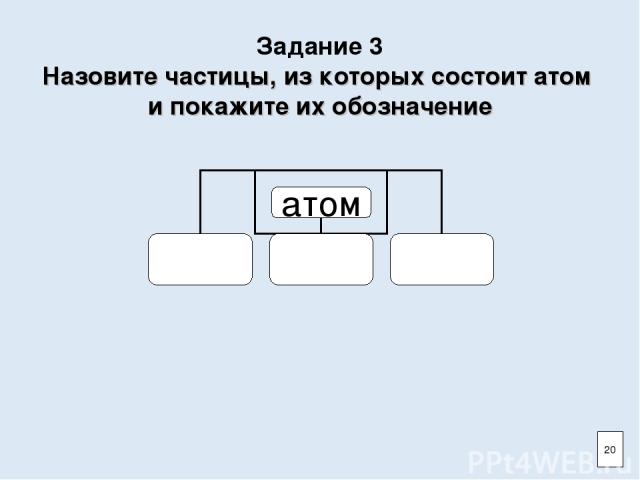
Задание 3 Назовите частицы, из которых состоит атом и покажите их обозначение 20

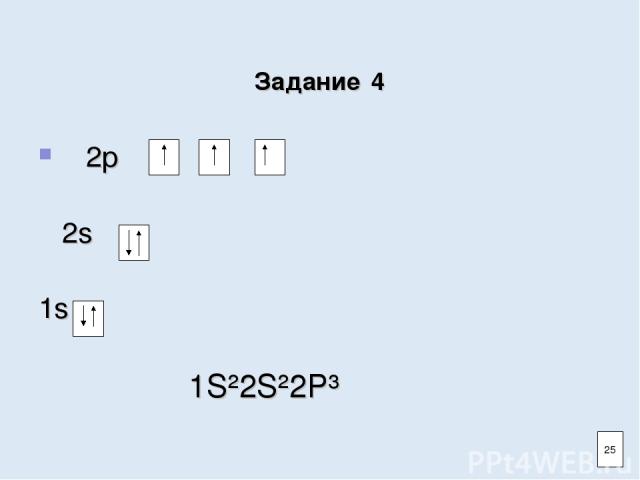
Задание 4 Заполните электронно-графическую схему атома азота 2р 2s 1s Напишите электронную формулу 21

электронейтральная ядра, электронной ядро 4. Э.Резерфорд, положительно 5. протоны и нейтроны 6. порядковому номеру 7. зарядом ядра 8. энергетическом 9. периода 10. два Правильные ответы Задание 1 22

Задание 2 1- А 2- Б 3- Г 4- В 5- А 6- Б 23
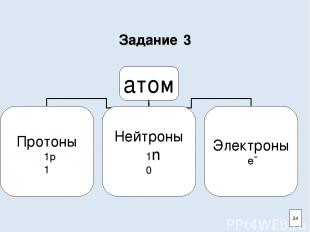
Задание 3 24
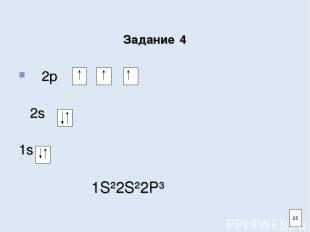
Задание 4 2р 2s 1s 1S²2S²2P³ 25

Критерий выставления оценок „5”-все задания выполнены без ошибок или с 1 незначительной ошибкой „4”- задания выполнены с 2-3 незначительными ошибками „3”- задания вызывают затруднения, выполнены с 4-5 ошибками „2”- задания не выполнены 26