Презентация на тему: Состав ядра. Ядерные силы

Цели урока: 1) Изучить протонно–нейтронную модель ядра – основу всех выводов в школьном курсе о строении и свойствах ядра; 2) Познакомить учащихся с ядерными силами, существенно отличающиеся от ранее известных. План урока: 1. Введение (1 - 2 мин.) - сообщение учителя. 2. Изучение нового материала (20 - 25 мин.) - рассказ учителя, беседа с учениками. 3. Закрепления нового материала (15 мин.) - выполнение упражнений. 4. Домашнее задание (1 - 2 мин.) - запись на доске. Урок по физике в 11 классе «Состав ядра. Ядерные силы»

Строение атома Конкретные представления о строении атома развивались по мере накопления физикой фактов о свойствах вещества. Открыли электрон, измерили его массу. Мысль об электронном строении атома, впервые высказанную В. Вебером в 1896 г., развил Х. Лоренц. Именно он создал электронную теорию: электроны входят в состав атома. Опираясь на эти открытия, Дж. Томсон в 1898 г. Предложил модель атома в виде положительно заряженного шара радиусом 10(-10) м, в котором плавают электроны, нейтрализующие положительный заряд (рис. 1) Рис. 1
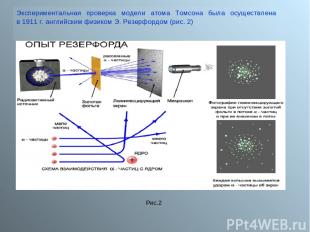
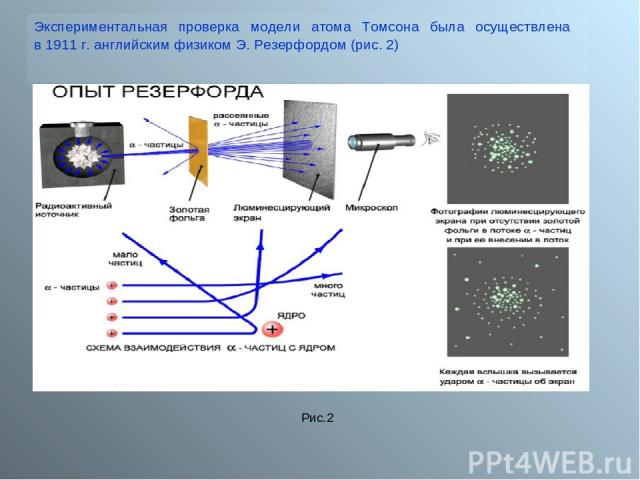
Экспериментальная проверка модели атома Томсона была осуществлена в 1911 г. английским физиком Э. Резерфордом (рис. 2) Рис.2

Пропуская пучок Альфа- частиц через тонкую золотую фольгу, Э. Резерфорд обнаружил, что какая-то часть частиц отклоняется на довольно значительный угол от своего первоначального направления, а небольшая часть – отражается от фольги. Но согласно модели атома Томсона, частицы могли отклоняться только на углы около 20 (рис.3) Резерфорд показал, что модель Томсона находится в противоречии с его опытами. Обобщая результаты своих опытов. Резерфорд предложил ядерную ( планетарную) модель строения атома (рис.4) Атом имеет ядро, размеры которого малы по сравнению с размерами самого атома (рис. 5) В ядре сконцентрирована почти вся масса атома. Отрицательный заряд всех электронов распределен по всему объему атома. Рис.3 Рис. 5 Рис.4
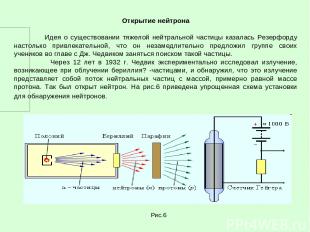
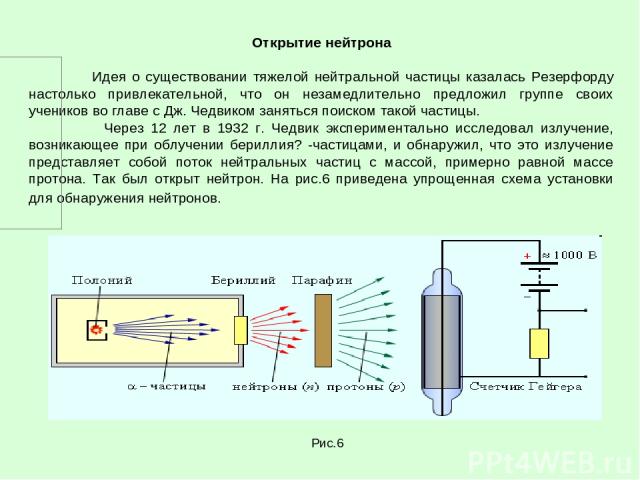
Открытие нейтрона Идея о существовании тяжелой нейтральной частицы казалась Резерфорду настолько привлекательной, что он незамедлительно предложил группе своих учеников во главе с Дж. Чедвиком заняться поиском такой частицы. Через 12 лет в 1932 г. Чедвик экспериментально исследовал излучение, возникающее при облучении бериллия? -частицами, и обнаружил, что это излучение представляет собой поток нейтральных частиц с массой, примерно равной массе протона. Так был открыт нейтрон. На рис.6 приведена упрощенная схема установки для обнаружения нейтронов. Рис.6

Нейтрон – это элементарная частица. Это не протон -электронная пара, как первоначально предполагал Резерфорд. По современным измерениям, масса нейтрона mn = 1,67493·10–27 кг = 1,008665 а.е.м. В энергетических единицах масса нейтрона равна 939,56563 МэВ. Масса нейтрона приблизительно на две электронные массы превосходит массу протона. Протон-нейтронная модель ядра Сразу же после открытия нейтрона российский ученый Д. Д. Иваненко и немецкий физик В. Гейзенберг выдвинули гипотезу о протонно-нейтронном строении атомных ядер, которая полностью подтвердилась последующими исследованиями (рис. 7) По современным измерениям, положительный заряд протона в точности равен элементарному заряду e = 1,60217733·10–19 Кл, то есть равен по модулю отрицательному заряду электрона. В настоящее время равенство зарядов протона и электрона проверено с точностью 10–22. Такое совпадение зарядов двух непохожих друг на друга частиц вызывает удивление и остается одной из фундаментальных загадок современной физики. Масса протона, по современным измерениям, равна mp = 1,67262·10-27 кг. Протоны и нейтроны в ядре принято называть нуклонами. Рис. 7

Ядро атома состоит из нуклонов, которые подразделяются на протоны и нейтроны. Символическое обозначение ядра атома А - число нуклонов, т.е. протонов + нейтронов (или атомная масса) Z - число протонов (равно числу электронов) N - число нейтронов (или атомный номер) N = A - Z

Для того, чтобы атомные ядра были устойчивыми, протоны и нейтроны должны удерживаться внутри ядер огромными силами, во много раз превосходящими силы кулоновского отталкивания протонов. Силы, удерживающие нуклоны в ядре, называются ядерными ( рис.8) Особенности ядерных сил: Ядерные силы примерно в 100 раз превосходят электростатические силы и на десятки порядков превосходят силы гравитационного взаимодействия нуклонов. 2. Важной особенностью ядерных сил является их короткодействующий характер. Ядерные силы заметно проявляются, как показали опыты Резерфорда по рассеянию a-частиц, лишь на расстояниях порядка размеров ядра (10–14–10–15 м). Ядерные силы очень быстро спадают с расстоянием. Радиус их действия порядка 0,000 000 000 000 001 метра. Для этой сверхмалой длины, характеризующей размеры атомных ядер, ввели специальное обозначение Фм (в честь итальянского физика Э. Ферми, 1901-1954) Все ядра имеют размеры нескольких Ферми. Радиус ядерных сил равен размеру нуклона, поэтому ядра – концентрация и очень плотной материи. Возможно, самой плотной в земных условиях. Ядерные силы - сильные взаимодействия. На больших расстояниях проявляется действие сравнительно медленно убывающих кулоновских сил. На основании опытных данных можно заключить, что протоны и нейтроны в ядре ведут себя одинаково в отношении сильного взаимодействия, т. е. ядерные силы не зависят от наличия или отсутствия у частиц электрического заряда. ЯДЕРНЫЕ СИЛЫ силы притяжения; действуют между всеми нуклонами в ядре; короткодействующие. . Рис.8

ЗНАЕШЬ ЛИ ТЫ ? В середине XX века теория ядра предсказала существование стабильных элементов с порядковыми номерами Z = 110 -114 В Дубне был получен 114-й элемент с атомной массой А = 289, который "жил" всего 30 секунд, что невероятно долго для атома с ядром такого размера. Сегодня теоретики уже обсуждают свойства сверхтяжелых ядер массой 300 и даже 500.

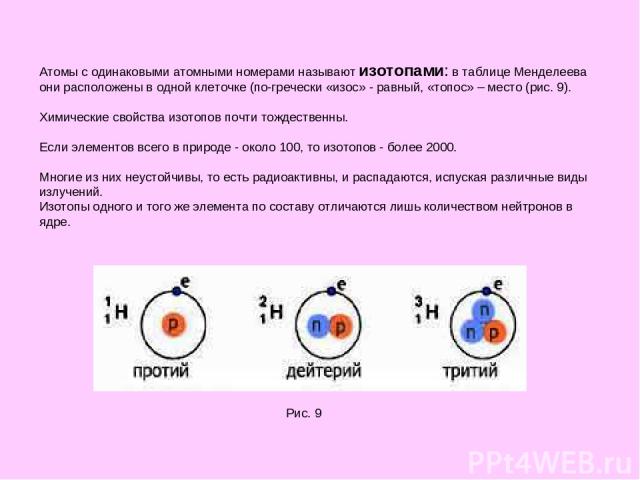
Атомы с одинаковыми атомными номерами называют изотопами: в таблице Менделеева они расположены в одной клеточке (по-гречески «изос» - равный, «топос» – место (рис. 9). Химические свойства изотопов почти тождественны. Если элементов всего в природе - около 100, то изотопов - более 2000. Многие из них неустойчивы, то есть радиоактивны, и распадаются, испуская различные виды излучений. Изотопы одного и того же элемента по составу отличаются лишь количеством нейтронов в ядре. Рис. 9

Решение задач: Сколько нуклонов, протонов и нейтронов содержится в ядрах следующих элементов: 11 Na23 A = 23 N = 23 – 11 = 12 Z = 11 11Na21 A = 21 N = 21 – 11 = 9 Z = 11 4B 9 A = 9 N = 9 – 4 = 5 Z = 4 Самостоятельно: 8O16 3Li7 6C12 7N14 9F19 13Al27 92U235 82Pb207 2. Чем отличаются следующие элементы: 8О17 и 8О16 92U235 и 92U239

Домашнее задание: п. 105 упр. 14 (4)