Презентация на тему: Источники загрязнения Атмосферы

«Источники загрязнения Атмосферы»

Загрязнение атмосферы-… …это проникновение в атмосферный воздух новых нехарактерных для него физических, химических и биологических веществ или изменение в естественной среде многолетней концентрации этих веществ.

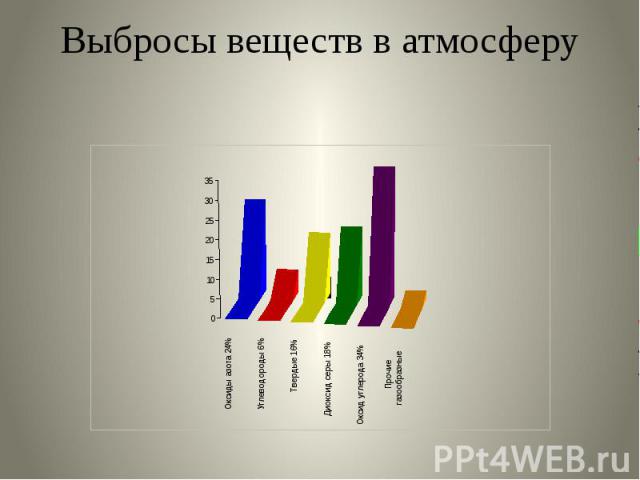
Основные загрязнители атмосферного воздуха: Оксид углеродаОксиды азотаДиоксид серыУглеводородыАльдегидыТяжёлые металлыАммиак
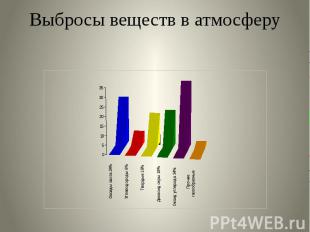
Выбросы веществ в атмосферу

ЗАКОН «О ЧИСТОМ ВОЗДУХЕ»

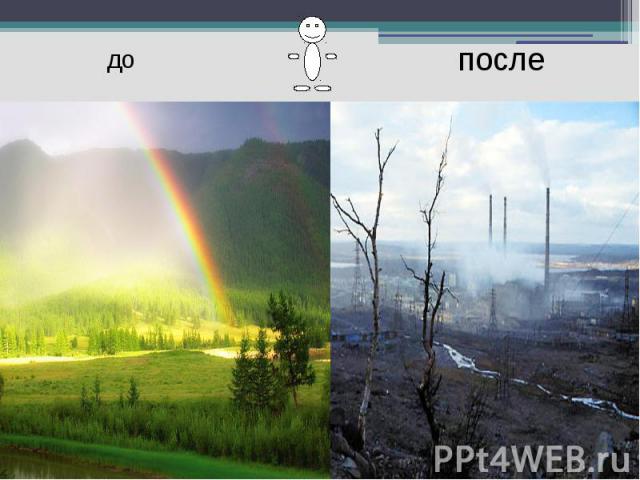
Смог Смог-это туман, смешанный с пылью, сажей и ядовитыми газами.Смог оказывает влияние на отражающую способность ЗемлиЧастицы пыли сокращают доступ ультрафиолетовой радиации и образуют избыточное количество паров воды.Всё это увеличивает отражающую способность атмосферы и приводит к похолоданию климата.

Что такое угарный газ? Угарный газ (оксид углерода (II) — бесцветный ядовитый газ без вкуса и запаха. Химическая формула — CO. Угарный газ— один из наиболее распространенных отравляющих газов в природе, загрязняющих окружающую среду. Главным источником СО является неполное сгорание ископаемого топлива, особенно угля. Выхлопные газы служат одним из главных источников образования СО в окружающей среде.

Пирометаллургия - получение металлов и сплавов под действием высоких температур. Восстановление металлов угарным газом: PbO + CО = CO2 + Pb

Физиологическое действие угарного газа на организм. Угарный газ очень ядовит. Первыми признаками острого отравления СО являются головная боль и головокружение, в дальнейшем наступает потеря сознания. Основным противоядием при отравлении СО служит свежий воздух. Полезно также кратковременное вдыхание паров нашатырного спирта.

Оксид углерода (IV) Углекислый газГаз без цвета и запаха. Это кислотный оксид, ему соответствует двухосновная угольная кислота. Растворение оксида углерода (IV) — обратимый процесс, в результате которого образуется угольная кислота.H2O + CO2 H2CO3
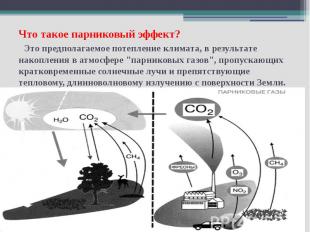
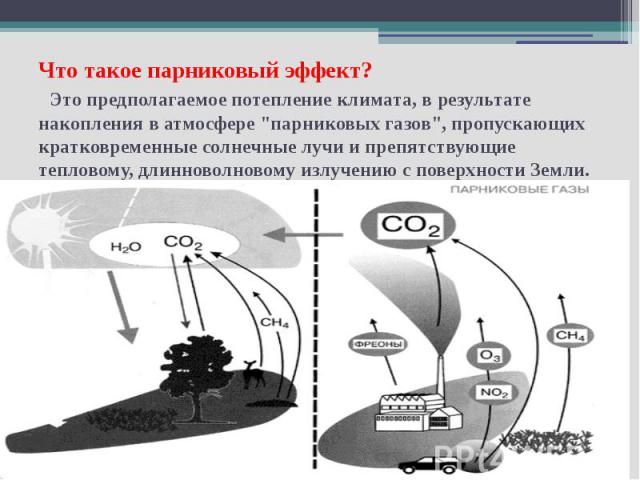
Что такое парниковый эффект? Это предполагаемое потепление климата, в результате накопления в атмосфере "парниковых газов", пропускающих кратковременные солнечные лучи и препятствующие тепловому, длинноволновому излучению с поверхности Земли.

Применение углекислого газа

SO2 оксид серы(IV) Сернистый газ Физические свойства SO2 газ бесцветный запах резкий, удушливый tкип = -10С Химические свойства SO2Кислотный оксид Обладает всеми свойствами кислотных оксидов Слабая сернистая кислота H2O+SO2 H2SO3

. Кислотные дожди Любая дождевая вода обладает очень слабой степенью кислотности. Однако при сгорании продуктов переработки природного топлива выделяются химические вещества, намного увеличивающие кислотность влаги, которая содержится в атмосфере. В конечном итоге эта влага выпадает на землю в виде кислотного дождя.

до после

Оксид азота (II)NO Бесцветный газ, не имеет запаха. В воде малорастворим. Образуется из азота и кислорода при сильных электрических разрядах (например, во время грозы в воздухе) или при высокой температуре: N2 + O2 2NO

Оксид азота (IV)- NO2Кислотный оксид2NO2 + H2O = HNO2 + HNO3Ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде.

Применение азотной кислоты: - производство азотных и комбинированных удобрений, - взрывчатых веществ (тринитротолуола и др.), - органических красителей. - как окислитель ракетного топлива.- в металлургии азотная кислота применяют для травления и растворения металлов, а также для разделения золота и серебра.

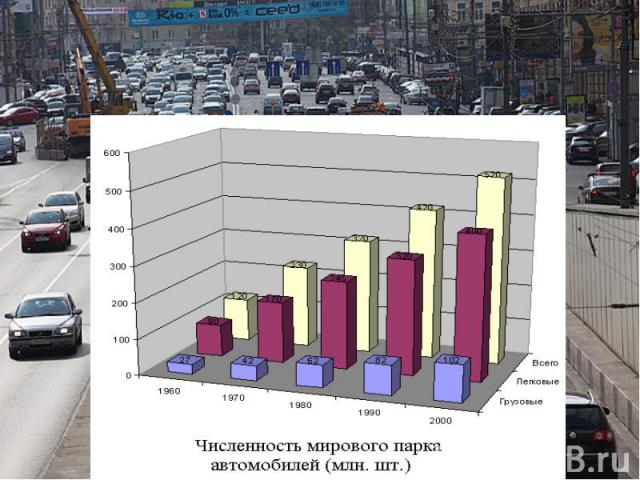
Меры по охране атмосферы от загрязнения: Разработать стандарты по выхлопным газам для автомобилей.Прекратить вырубку лесов.Устанавливать очистные сооружения на предприятиях химической промышленности.Осуществить переход на использование бестопливных источников энергии.

СПАСИБО ЗА УРОК!