Презентация на тему: Биологическое окисление



Энергетическое обеспечение: Энергетическое обеспечение: а) поддержания температуры тела; б) биолюминесценции (свечения); в) химических синтезов; г) осмотических явлений; д) электрических процессов; е) механической работы. Синтез важнейших (ключевых) метаболитов. Регуляция обмена веществ. Устранение вредных для клетки продуктов обмена (шлаков). Детоксикация проникших в организм чуждых соединений – ксенобиотиков (пестицидов, препаратов бытовой химии, лекарственных средств, промышленных загрязнений и т.п.).

Разнообразные реакции биологического окисления ускоряются многочисленными ферментами оксидоредуктазами, которые, как правило, встроены в биологические мембраны, причем очень часто в виде ансамблей. Разнообразные реакции биологического окисления ускоряются многочисленными ферментами оксидоредуктазами, которые, как правило, встроены в биологические мембраны, причем очень часто в виде ансамблей. Их разделяют на 5 групп: Оксидазы (катализируют удаление водорода из субстрата, используя при этом в качестве акцептора водорода только кислород)

Аэробные дегидрогеназы (в отличие от оксидаз они могут использовать в качестве акцептора водорода не только кислород, но и искусственные акцепторы) Аэробные дегидрогеназы (в отличие от оксидаз они могут использовать в качестве акцептора водорода не только кислород, но и искусственные акцепторы)

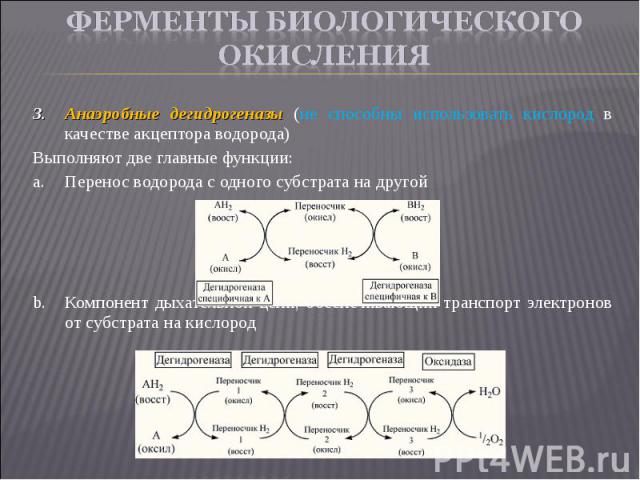
Анаэробные дегидрогеназы (не способны использовать кислород в качестве акцептора водорода) Анаэробные дегидрогеназы (не способны использовать кислород в качестве акцептора водорода) Выполняют две главные функции: Перенос водорода с одного субстрата на другой Компонент дыхательной цепи, обеспечивающий транспорт электронов от субстрата на кислород

Гидроксипероксидазы (используют в качестве субстрата перекись водорода или органические перекиси) Гидроксипероксидазы (используют в качестве субстрата перекись водорода или органические перекиси) Оксигеназы (катализируют прямое введение кислорода в молекулу субстрата)

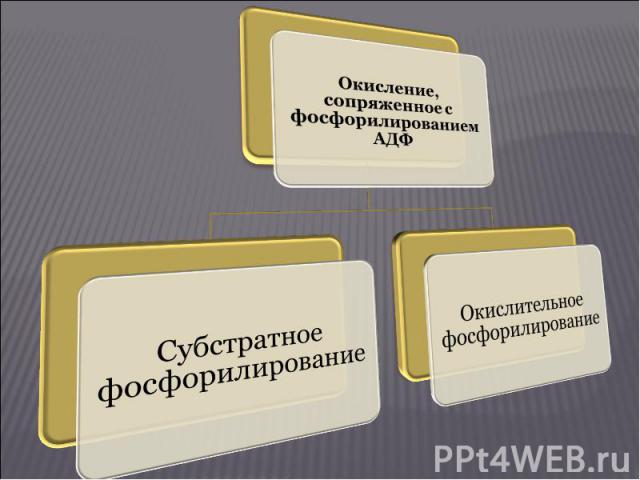
Существуют 2 типа биологического окисления: Существуют 2 типа биологического окисления: Свободное окисление Окисление, не сопряженное с фосфорилированием АДФ и не сопровождающееся трансформацией энергии, выделяющейся при окислении, в энергию макроэргических связей. При свободном окислении высвобождающаяся энергия переходит в тепловую и рассеивается. Окисление, сопряженное с фосфорилированием АДФ Этот тип биологического окисления осуществляется двумя путями: субстратное фосфорилирование окислительное фосфорилирование


Реакции свободного окисления органических соединений в живой природе и ускоряющие их ферментные системы многообразны. Этим путем непосредственно окисляются не только многочисленные природные и неприродные субстраты, но и восстановленные коферменты (НАДН, НАДФН, ФАД·Н2 и др.), образовавшиеся при действии первичных и вторичных дегидрогеназ. Реакции свободного окисления органических соединений в живой природе и ускоряющие их ферментные системы многообразны. Этим путем непосредственно окисляются не только многочисленные природные и неприродные субстраты, но и восстановленные коферменты (НАДН, НАДФН, ФАД·Н2 и др.), образовавшиеся при действии первичных и вторичных дегидрогеназ. Реакции свободного окисления протекают в цитозоле, на мембранах различных субклеточных структур, в ядерном аппарате клетки. Основным средоточием их являются мембраны эндоплазматической сети (ЭПС). Так как мембраны ЭПС при гомогенизации клеток и фракционировании субклеточных частиц гомогената дают фракцию микросом, то реакции окисления на мембранах ЭПС называются микросомальным окислением.

1) Несмотря на наличие ферментов цепи переноса электронов, ни в одном пункте этой цепи не происходит сопряжения с фосфорилированием АДФ. 1) Несмотря на наличие ферментов цепи переноса электронов, ни в одном пункте этой цепи не происходит сопряжения с фосфорилированием АДФ. 2) Своеобразие структуры и функциональной активности цитохромов b5 и Р–450, входящих в ее состав. 3) Высокое сродство терминальной оксидазы микросомальных цепей к кислороду, позволяющее ей конкурировать за кислород с митохондриальной цитохромоксидазой.


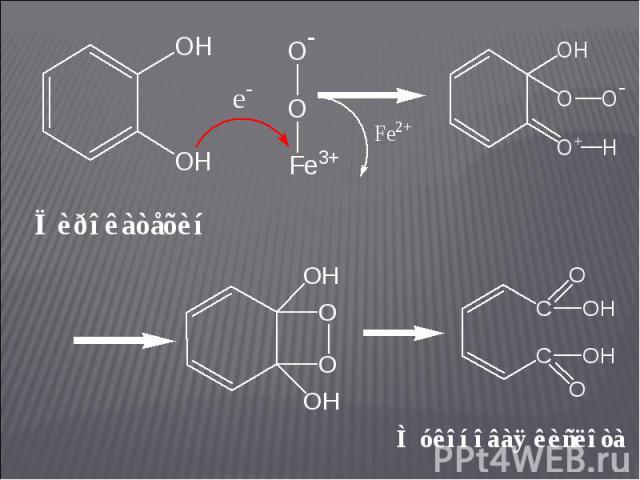
Пирокатехаза (катехол: кислород-1,2-оксидоредуктаза дециклизующая) Пирокатехаза (катехол: кислород-1,2-оксидоредуктаза дециклизующая) Она содержит в активном центре два прочно связанных атома Fе, которые, согласно О. Хайаиши, соединяются с молекулярным кислородом в комплекс, где кислород далее активируется: Fe2+ + О2 → Fе2+О2 → Fе3+О2–

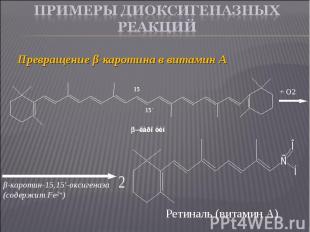
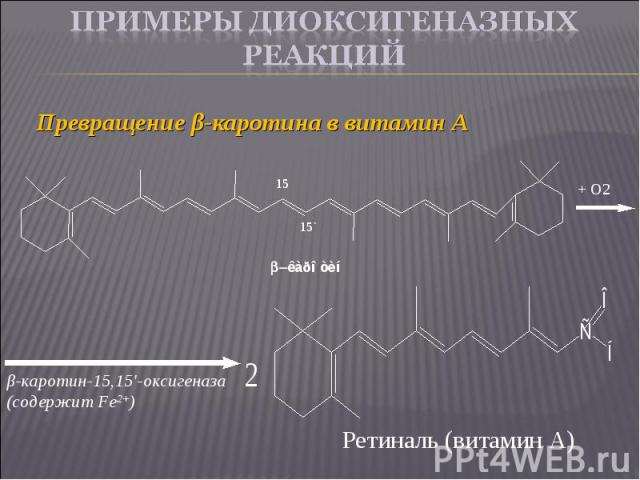
Превращение β-каротина в витамин А Превращение β-каротина в витамин А
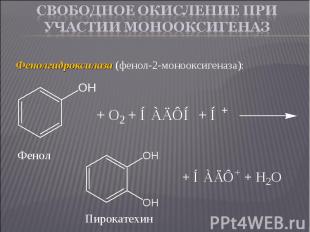
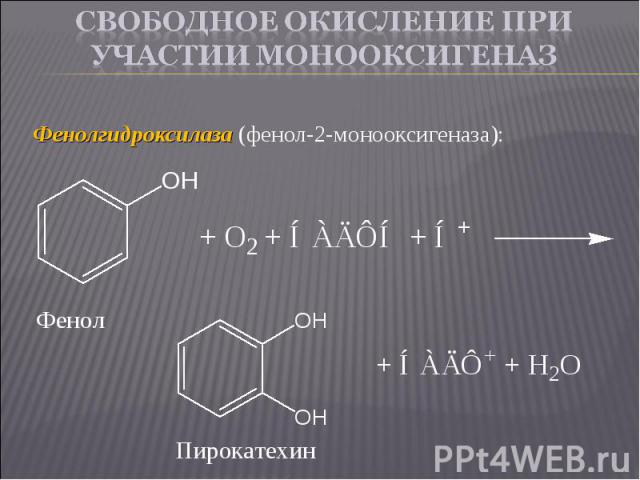
Фенолгидроксилаза (фенол-2-монооксигеназа): Фенолгидроксилаза (фенол-2-монооксигеназа):



Субстратное фосфорилирование – такой вид биологического окисления, при котором: Субстратное фосфорилирование – такой вид биологического окисления, при котором: макроэргическая связь возникает в момент непосредственного окисления субстрата, затем тем или иным путем передается на фосфатный остаток, который, в свою очередь, используется для фосфорилирования АДФ, т.е. синтеза АТФ. Окисление, сопряженное с фосфорилированием АДФ на уровне субстрата.

При окислении 3-фосфоглицеринового альдегида (3-ФГА) в 2-фосфоглицериновую кислоту (2-ФГК) – гликолиз; При окислении 3-фосфоглицеринового альдегида (3-ФГА) в 2-фосфоглицериновую кислоту (2-ФГК) – гликолиз; При превращении фосфоенолпировиноградной кислоты (ФЕП) в пировиноградную (пируват, ПВК) – гликолиз; При превращении -кетоглутаровой кислоты в янтарную (реакция цикла Кребса).
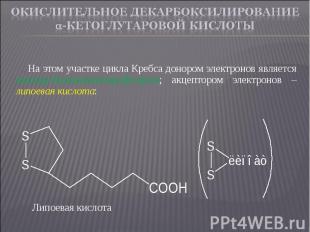
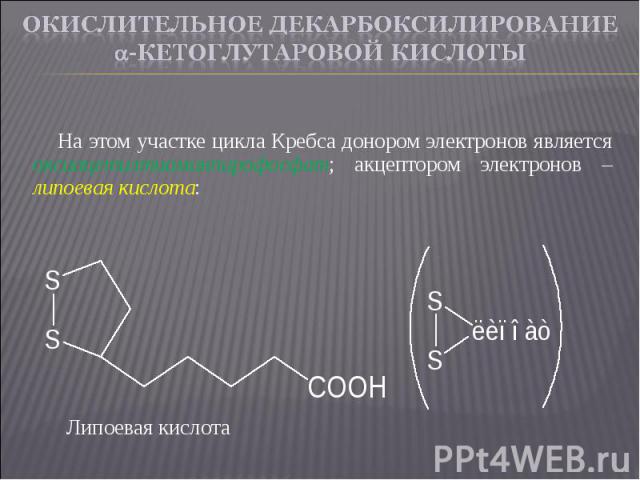
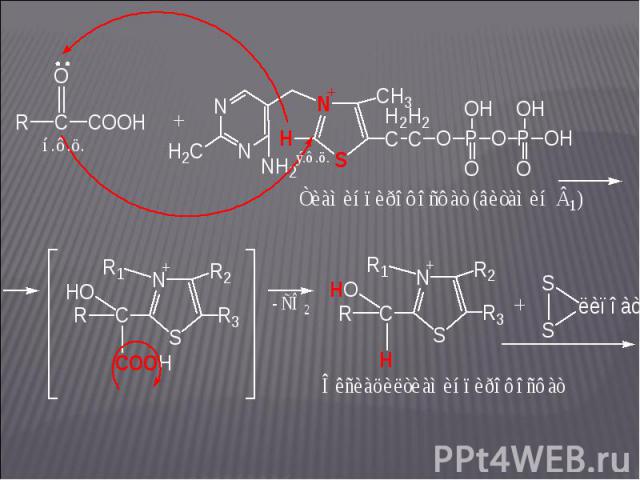
На этом участке цикла Кребса донором электронов является оксиацетилтиаминпирофосфат; акцептором электронов – липоевая кислота: На этом участке цикла Кребса донором электронов является оксиацетилтиаминпирофосфат; акцептором электронов – липоевая кислота:
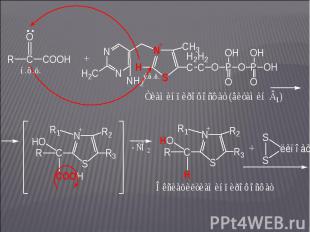
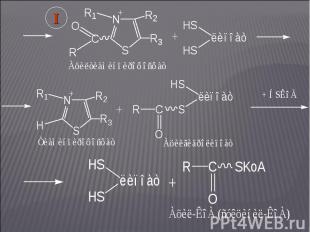
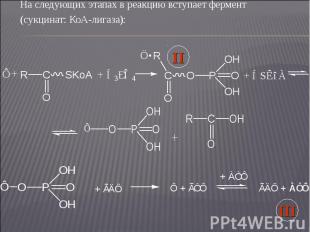
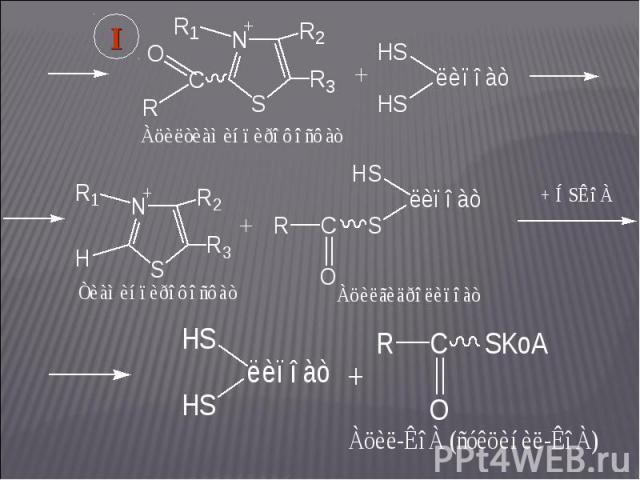
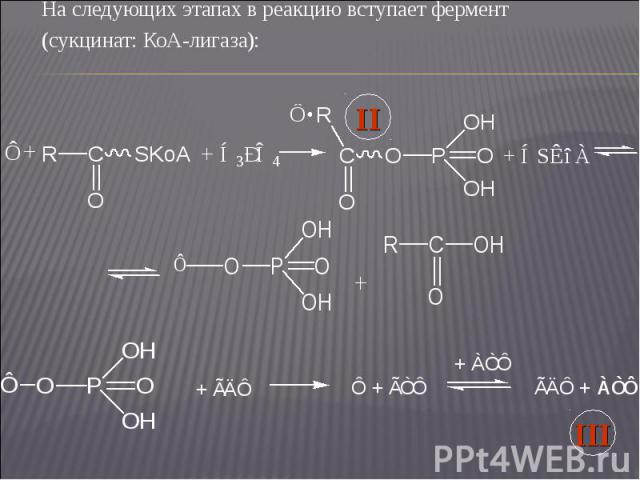
На следующих этапах в реакцию вступает фермент На следующих этапах в реакцию вступает фермент (сукцинат: КоА-лигаза):


Это сопряжение окисления с синтезом АТФ, когда атомы водорода с коферментов дегидрогеназ, принимающих участие в окислении субстратов, передаются в оксидоредуктазную цепь, где сопряжено с переносом ионов Н+ и электронов на молекулярный кислород происходит активирование неорганического фосфата и при его посредстве – фосфорилирование АДФ с образованием АТФ Это сопряжение окисления с синтезом АТФ, когда атомы водорода с коферментов дегидрогеназ, принимающих участие в окислении субстратов, передаются в оксидоредуктазную цепь, где сопряжено с переносом ионов Н+ и электронов на молекулярный кислород происходит активирование неорганического фосфата и при его посредстве – фосфорилирование АДФ с образованием АТФ Окисляемый субстрат в этом случае непосредственного участия в активировании неорганического фосфата не принимает Сопряжение окисления с фосфорилированием идет главным образом на внутренних мембранах митохондрий

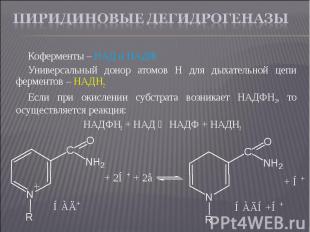
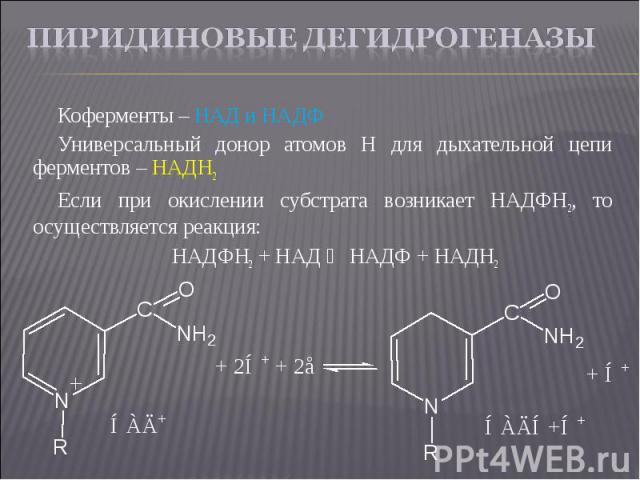
Коферменты – НАД и НАДФ Коферменты – НАД и НАДФ Универсальный донор атомов Н для дыхательной цепи ферментов – НАДН2 Если при окислении субстрата возникает НАДФН2, то осуществляется реакция: НАДФН2 + НАД ⇄ НАДФ + НАДН2

Легкая обратимость. Легкая обратимость. Коферменты легко отделяются от белковой части, обладают высокой подвижностью, что позволяет им переносить атомы Н, ионы Н+ и электроны из одной части клетки в другую. НАД и НАДФ способны принимать атомы Н от большого числа субстратов, окислительно-восстановительные потенциалы которых ниже (-0,32В).

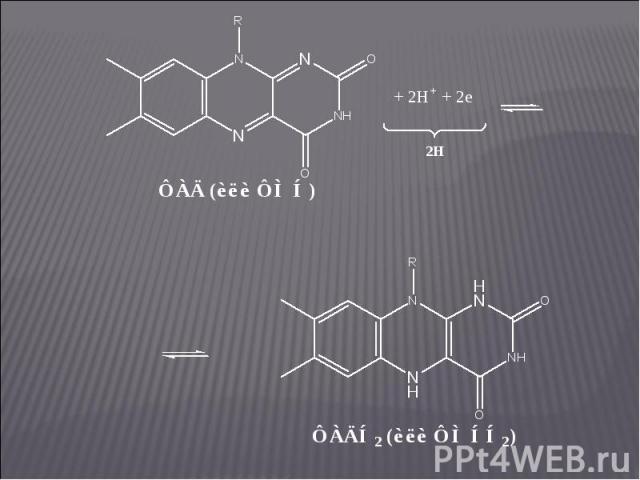
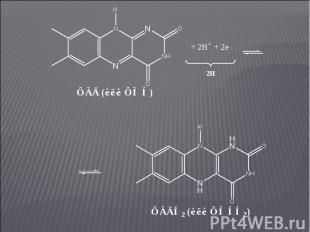
Коферменты – ФМН и ФАД. Коферменты – ФМН и ФАД. Флавиновые ферменты являются акцепторами атомов водорода и осуществляют перенос их от НАДН2: НАДН2 + ФАД ⇄ НАД + ФАДН2. В некоторых случаях (при окислении янтарной кислоты в цикле Кребса или при окислении жирных кислот) флавиновые ферменты могут играть роль первичных дегидрогеназ. ФМН и ФАД очень прочно связаны с апоферментом и не отщепляются от него ни на одной стадии каталитического цикла. Активной частью молекул ФАД и ФМН является изоаллоксазиновое кольцо рибофлавина, к атомам азота которого могут присоединяться 2 атома водорода:
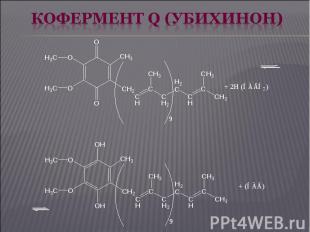

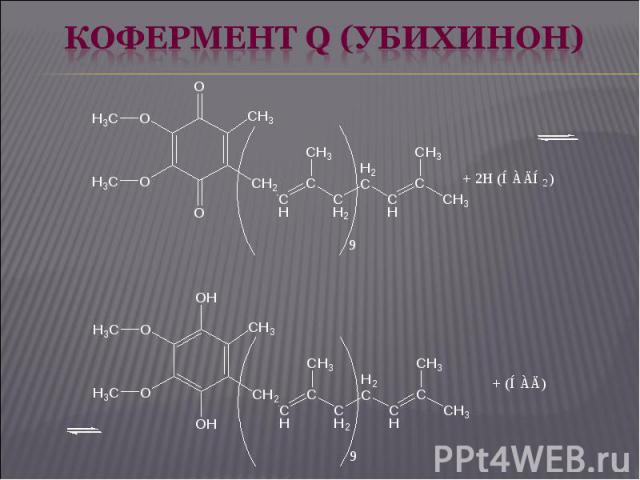
Дальнейший перенос электронов от КоQ на кислород осуществляет система цитохромов, состоящая из ряда гемопротеидов, расположенных в порядке возрастания окислительно-восстановительных потенциалов, что обеспечивает упорядоченную передачу электронов. Цитохромы а и а3 содержат в своем составе еще и атомы меди. Дальнейший перенос электронов от КоQ на кислород осуществляет система цитохромов, состоящая из ряда гемопротеидов, расположенных в порядке возрастания окислительно-восстановительных потенциалов, что обеспечивает упорядоченную передачу электронов. Цитохромы а и а3 содержат в своем составе еще и атомы меди. При транспорте электронов в направлении увеличения окислительно-восстановительных потенциалов происходят процессы: Fe2+ ⇄ Fe3+ (в цит. b, c1, с) Cu+ ⇄ Cu2+ (в цит. а, а3).


Самой примечательной особенностью дыхательной цепи ферментов является наличие в ней участков, где соседние компоненты резко отличаются значениями окислительно-восстановительных потенциалов. Самой примечательной особенностью дыхательной цепи ферментов является наличие в ней участков, где соседние компоненты резко отличаются значениями окислительно-восстановительных потенциалов. Именно здесь происходит сопряжение окисления с фосфорилированием АДФ, т.к. разность энергетических уровней электрона, транспортируемого с огромной скоростью, вполне достаточна для синтеза макроэргической связи и составляет 51 кДж для I, 36 кДж – для II и 80,7 кДж – для III точки сопряжения.

Питер Митчелл, Владимир Петрович Скулачев Питер Митчелл, Владимир Петрович Скулачев Реакции, сопровождающиеся расходованием или образованием Н+, протекают на внутренней мембране митохондрий таким образом, что протоны переносятся с внутренней мембраны на внешнюю, т.е. перенос электронов сопровождается возникновением трансмембранного градиента концентрации ионов Н+ – совершением осмотической работы. Этот градиент, создающий разность химических ( ) и электрических ( ) потенциалов, является источником энергии для протекания эндэргонического процесса образования АТФ. АТФаза является ферментом, способным использовать градиент концентрации ионов Н+ для обращения процесса гидролиза АТФ.