Презентация на тему: как классифицируют живые организмы


дать представление о причинах единства всех типов химической связи дать представление о причинах единства всех типов химической связи


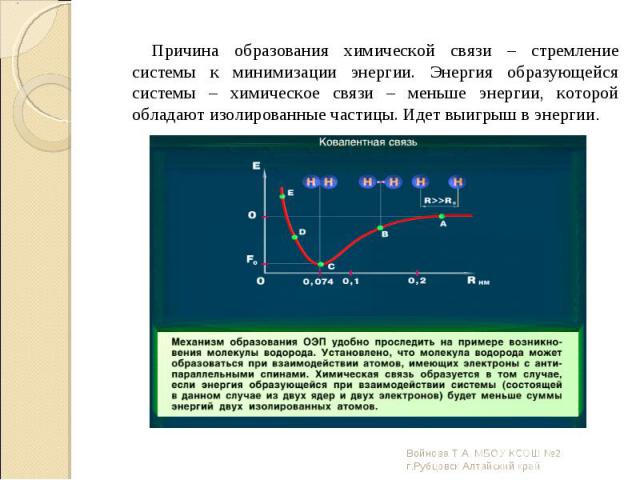
Любая химическая связь образуется только тогда, когда сближение частиц приводит к понижению полной энергии системы. Любая химическая связь образуется только тогда, когда сближение частиц приводит к понижению полной энергии системы. Определяющим является: энергия взаимодействия – Е межъядерное расстояние – r
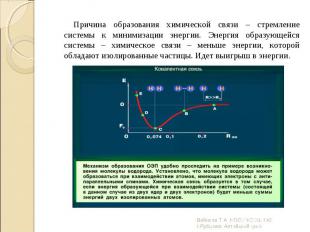
Причина образования химической связи – стремление системы к минимизации энергии. Энергия образующейся системы – химическое связи – меньше энергии, которой обладают изолированные частицы. Идет выигрыш в энергии. Причина образования химической связи – стремление системы к минимизации энергии. Энергия образующейся системы – химическое связи – меньше энергии, которой обладают изолированные частицы. Идет выигрыш в энергии.




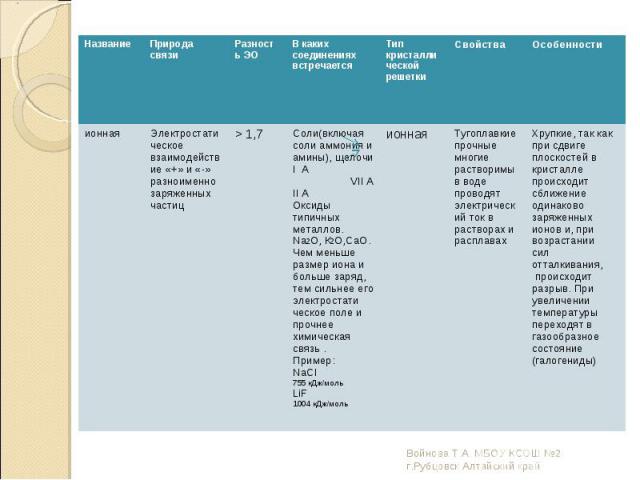
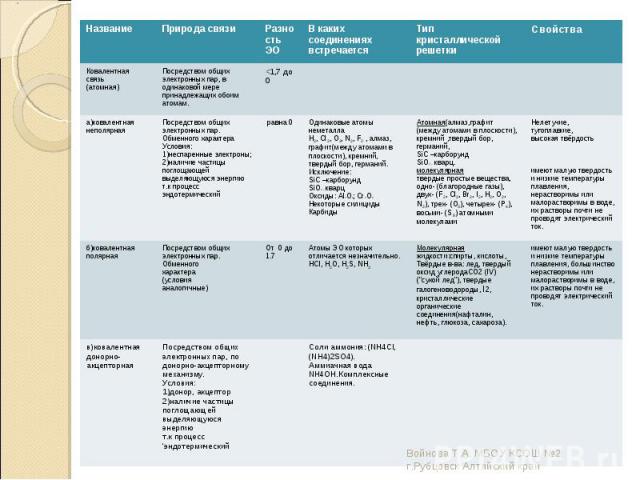
Равная ЭО – ковалентная неполярная; Равная ЭО – ковалентная неполярная; Разность ЭО < 1,7 -ковалентная полярная; Разность ЭО > 1,7 – ионная связь;

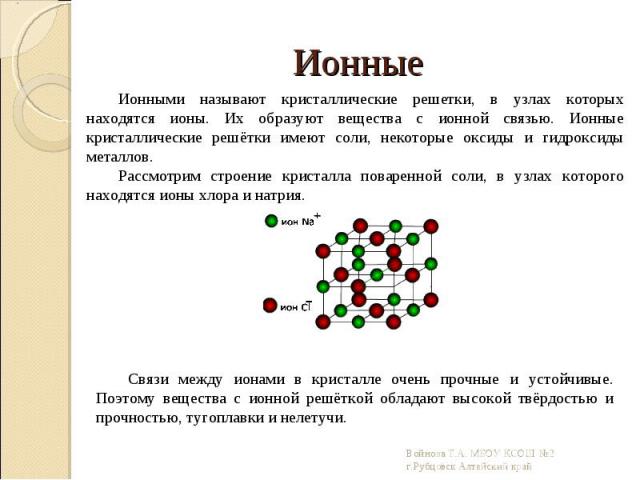
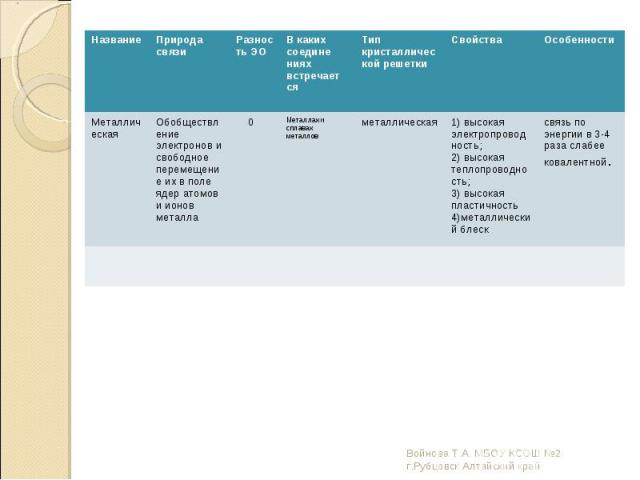
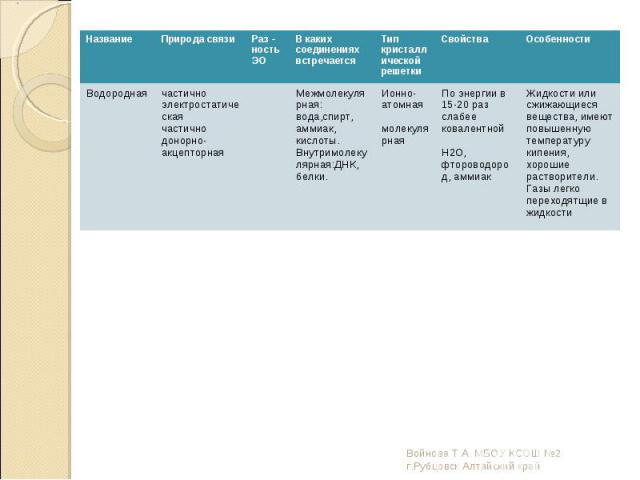
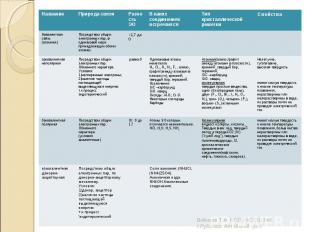
Кристаллические решётки веществ – это упорядоченное расположение частиц(атомов, молекул, ионов) в строго определённых точках пространства. Точки размещения частиц называют узлами кристаллической решётки. Кристаллические решётки веществ – это упорядоченное расположение частиц(атомов, молекул, ионов) в строго определённых точках пространства. Точки размещения частиц называют узлами кристаллической решётки. В зависимости от типа частиц, расположенных в узлах кристаллической решётки, и характера связи между ними различают 4 типа кристаллических решёток: ионные, атомные, молекулярные, металлические. Рассмотрим каждую из решёток в отдельности и поподробней.


Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными связями. Ниже показана кристаллическая решётка алмаза. Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными связями. Ниже показана кристаллическая решётка алмаза.

Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них ковалентные, как полярные, так и неполярные. Связи в молекулах прочные, но между молекулами связи не прочные. Ниже представлена кристаллическая решётка I2 Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них ковалентные, как полярные, так и неполярные. Связи в молекулах прочные, но между молекулами связи не прочные. Ниже представлена кристаллическая решётка I2

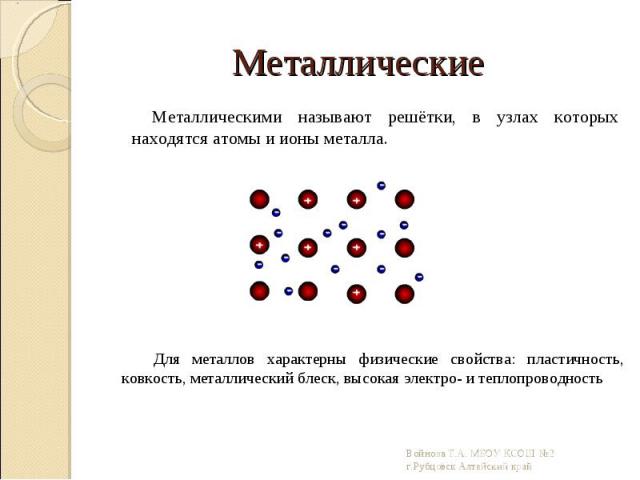
Металлическими называют решётки, в узлах которых находятся атомы и ионы металла. Металлическими называют решётки, в узлах которых находятся атомы и ионы металла.
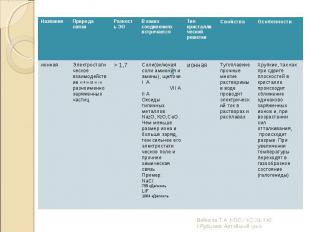
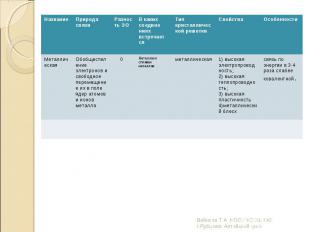
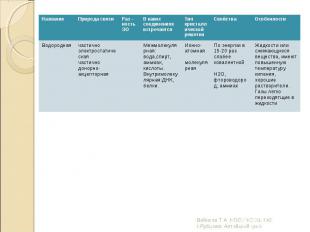

Электронно-ядерное взаимодействие атомов, сопровождающееся выделением энергии Электронно-ядерное взаимодействие атомов, сопровождающееся выделением энергии Часто встречаются соединения в которых несколько видов связи
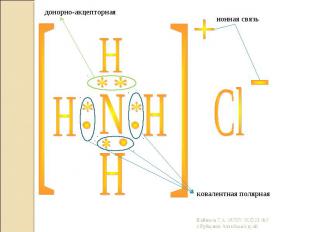

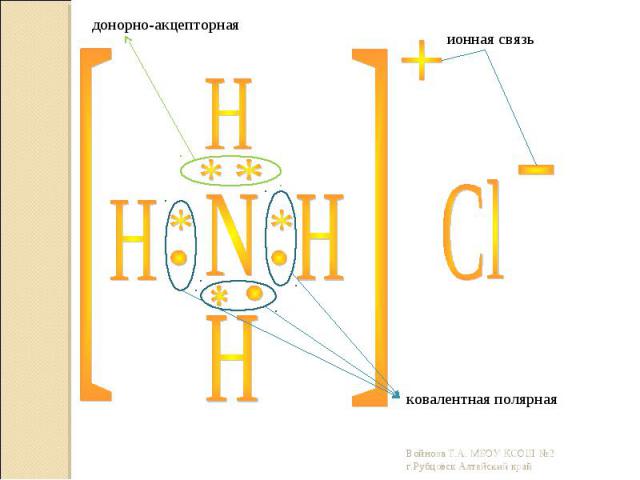
В зависимости от условий,возможен переход от одного вида связи в другой: В зависимости от условий,возможен переход от одного вида связи в другой: При электролитической диссоциации, соединения с ковалентной полярной связью, под влиянием сильно полярных молекул воды, становятся соединениями с ионной связью. При испарении металлов, металлическая связь превращается в ковалентную. В органической химии, ковалентная неполярная связь Br2, при его взаимодействии с непредельными углеводородами становится ионной План характеристики химической связи: Вид химической связи(учитывая ЭО элементов) Механизм их образования Какие возникают связи δ, π, кратность связи Соответствующий тип кристаллической решетки, физические свойства данного вещества



в в б б б в

Домашнее задание: Домашнее задание: - повторить § 6; - выполнить упр. 3,4,6 гл.3 Кузьменко. Вопросы 84-112

Габриелян О.С., Лысова Г.Г., . Общая химия.11класс., -М.: Дрофа, 2006. Габриелян О.С., Лысова Г.Г., . Общая химия.11класс., -М.: Дрофа, 2006. Габриелян О.С., Лысова Г.Г., Химия. 11 класс. Методическое пособие в 2х частях., - М.: Дрофа, 2003. Горковенко М.Ю. Поурочные разработки по химии 11 класс., - М.: Вако. 2005. Лидин Р.А. и др. Химия для школьников старших классов и поступающих в вузы. - М.: Дрофа, 2004. Троегубова Н.П. Поурочные разработки по химии. – М.:Дрофа, 2009.