Презентация на тему: Свойства серы

Sulfur

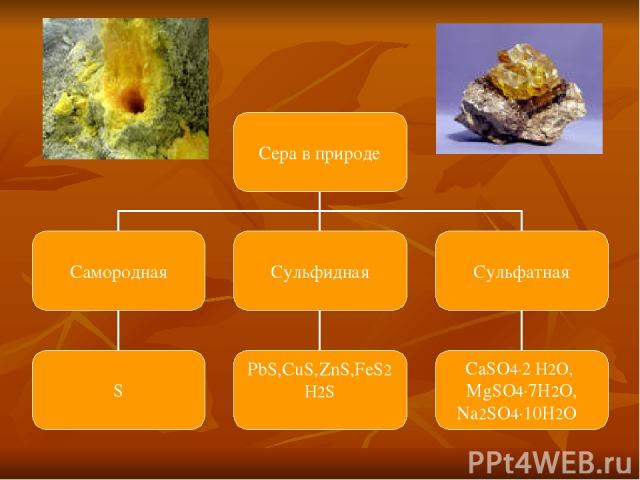
Сера известна человечеству с древних времен, т. к. она в природе встречается в самородном виде. Считалось, что голубое пламя и запах, распространяемый при горении серы, отгоняет демонов.

Сернистый газ использовали для отбеливания тканей. При раскопках Помпеи нашли картину, на которой изображен противень с серой и приспособление для подвешивания над ним материи.

Кроме того, серу и ее соединения использовали для приготовления косметических средств и для лечения кожных заболеваний..

Ее применяли для военных целей. Так в 670 г защитники Константинополя сожгли арабский флот с помощью смеси селитры, угля и серы (“греческий огонь”). Сера также входит в состав черного пороха
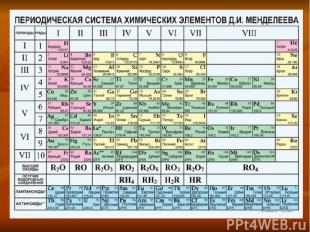

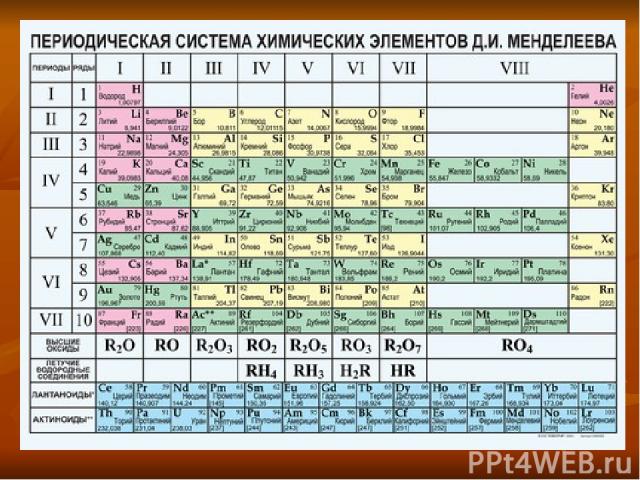
+16S а) находится в Vl группе, главной подгруппе б) lll период. 3 ряд в) неметалл г) проявляет степени окисления -2, 0,+2,+4,+6 д) образует кислотные оксиды SO2 (сернистый газ) и SO3 (серный газ) е) этим оксидам соответствуют кислоты H2SO3(сернистая) и H2SO4(серная) ё) с водородом образует летучее водородное соединение H2S

Схема расположения электронов на энергетических подуровнях +16S 1s2 2s2 2p6 3s2 3p4

Строение молекулы серы S8-молекула серы состоит из 8-и атомов связь в молекуле - ковалентная неполярная молекула неполярная кристаллическая решётка - молекулярная неполярная
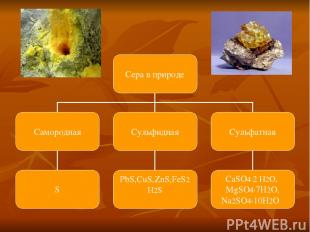

) Самородную серу очищают от примесей песка и глины. Для этого ее расплавляют перегретым водяным паром, в результате жидкая сера легко отделяется от твердых примесей. При затвердевании получается комовая сера, дальнейшую очистку которой проводят перегонкой. б) Из сульфидов t FeS2 =>FeS +S в) Из сероводорода - неполным окислением H2S+O2 =>S+H2O

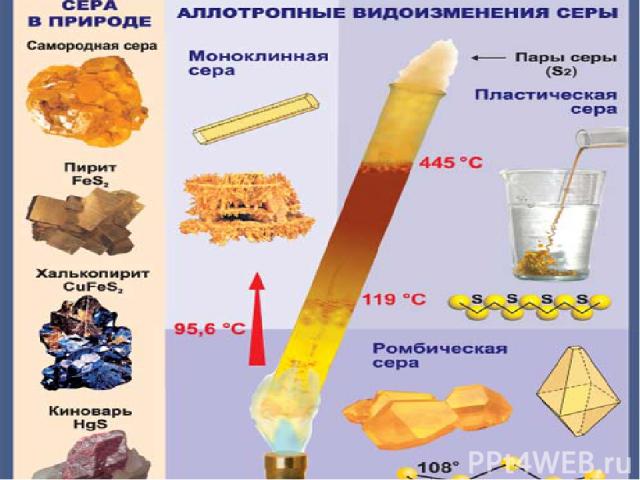
Физические свойства серы. Сера имеет несколько аллотропных модификаций. Наиболее устойчивы ромбическая и моноклинная. Это кристаллические вещества, которые различаются формой кристаллов и некоторыми физическими свойствами

Кристаллы состоят из молекул S8( кр. решетка молекулярная –неполярная) ромбическая сера имеет цвет лимонно-желтый, tпл.=112,8C, моноклинная сера имеет цвет темно-желтый tпл.=119.3C,

При быстром охлаждении расплавлено серый образуется ещё одна неустойчивая аллотропная модификация- пластическая сера Sn , которая легко растягивается подобно резине. S S S S S ..S S S S S S… В воде сера практически нерастворима. Хорошим растворителем для неё является сероуглерод, толуол и некоторые другие вещества.


Химические свойства. Окислительные свойства серы: а) Сера реагирует с металлами без нагревания и при нагревании ( из металлов сера не реагирует только с Au и Pt t t 2Na+S=>Na2S 2Al+3S=>Al2S3 Hg+S=>HgS - демеркуризация, реакция лежит в основе удаления и обезвреживания ртути б) при нагревании сера реагирует с водородом t H2 +S=>H2 S в)сера окисляет неметаллы электроотрицательность которых меньше t t 2Р+3S=>P2S3 C+2S =>CS2 сероуглерод

Восстановительные свойства серы: г)сера реагирует с галогенами 3F2+S => SF6 Cl2+S => SCl2 д) при нагревании сера реагирует с кислородом(горит) S+O2=> SO2

Сера реагирует и со сложными 3S + 4HNO3(конц.) => 3SO2↑ + 4NO↑ + 2H2O S + 2H2SO4 (конц.) => 3SO2↑ + 2H2O

Применение серы Большая часть серы используется для производства серной кислоты. Значительное количество серы расходуется для вулканизации каучука (она повышает его прочность и эластичность). При введении в каучук большого количества серы получают твердый продукт - эбонит, являющийся электроизоляционным материалом. Сера применяется для борьбы с вредителями сельского хозяйства, для изготовления черного пороха, а также в медицине для изготовления мазей против кожных заболеваний.

H2S-сероводород Степень окисления серы Получение -2 S+H2 =>H2S FeS+2HCl =>H2S+FeCl2

Физические свойства сероводорода 1.газ 2.бесцветный 3.запаз тухлых яиц 4.ядовит 5.хорошо растворим в воде(сероводородная кислота)

Большинство жителей Помпей погибли задохнувшись сероводородом, сернистым и серным газами! Извержение Везувия началось днём 24 августа 79 года и длилось около суток, о чём свидетельствуют некоторые сохранившиеся манускрипты «Писем» Плиния Младшего. Оно привело к гибели трёх городов — Помпеи, Геркуланум, Стабии и нескольких небольших селений и вилл. В процессе раскопок выяснилось, что в городах всё сохранилось таким, каким было до извержения. Под многометровой толщиной пепла были найдены улицы, дома с полной обстановкой, люди и животные, которые не успели спастись. Сила извержения была такова, что пепел от него долетал даже до Египта и Сирии. Из 20 000 жителей Помпей в зданиях и на улицах погибло около 2000 человек. Большинство жителей покинули город до катастрофы, однако останки погибших находят и за пределами города. Поэтому точное число погибших оценить невозможно.

Карл Брюллов "Последний день Помпеи", 1828 г.

Сероводород в глубинах Чёрного моря! В 1890 году русская океанографическая экспедиция доказала, что в глубинах Черного моря очень много растворенного сероводорода ядовитого газа с запахом тухлых яиц. Вскоре выяснилось, что сероводород присутствует во всей глубинной акватории Черного моря, приближаясь к поверхности примерно на 100 м в центре моря и до 300 м у берегов. Иногда верхняя граница сероводородной “зоны ненадолго поднимается и опускается из-за восходящих и нисходящих движений воды, вызванных, например, ветром.

Химические свойства сероводорода Слабая двухосновная кислота (cероводородная) Плохо диссоциирует в воде, слабый электролит. Растворы сероводородной кислоты имеют слабый запах тухлых яиц.

СОЛИ сероводородной кислоты Сульфиды или гидросульфиды Na2S или NaHS

SO2-оксид серы(lV) Сернистый газ Степень окисления серы Получение +4 S+O2 =>SO2 2H2S+3O2=>2SO2+2H2O

Физические свойства SO2 1.газ 2бесцветный 3.запах резкий, удушающий 4.tкип = -10С

Химические свойства SO2 Кислотообразующий оксид Обладает всеми свойствами кислотных оксидов ( перечислите их)

гидроксид Слабая сернистая кислота H2O+SO2 H2SO3

Соли сернистой кислоты Сульфиты или гидросульфиты Na2SO3 или NaHSO3

SO3-оксид серы (Yl) Cерный газ Степень окисления серы Получение +6 V2O5,t 2SO2+O2 SO3

Физические свойства SO3. 1.жидкость 2.бесцветная 3.сильно дымит на воздухе 4.tкип=44,70С

Химические свойства SO3 Кислотообразующий оксид Обладает всеми свойствами кислотных оксидов

Гидроксид ( соединение SO3 с водой) Сильная серная кислота H2O+SO3 =>H2SO4

Соли серной кислоты Cульфаты или гидросульфаты Na2SO4 или NaHSO4