Презентация на тему: Соли

Соли.

Понятие: Соли -сложные вещества, состоящие из атома металла и кислотного остатка (иногда содержат водород). Соли могут рассматриваться как продукты замещения протонов водорода кислоты на ионы металлов, NH4+, СН3NН3+ и др. катионы или групп ОН основания на анионы кислот (напр., Cl-, SO42-).

Названия солей образуются из двух слов: название аниона в именительном падеже и название катиона в родительном падеже

Физические свойства. Соли - твердые кристаллические вещества. Многие вещества имеют высокие температуры плавления и кипения. По растворимости делятся на растворимые и нерастворимые. К растворимым относят почти все соли натрия, калия и аммония, многие нитраты, ацетаты и хлориды.
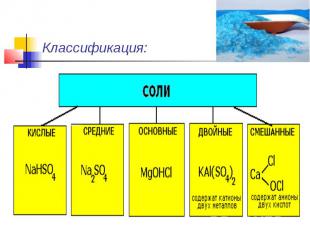
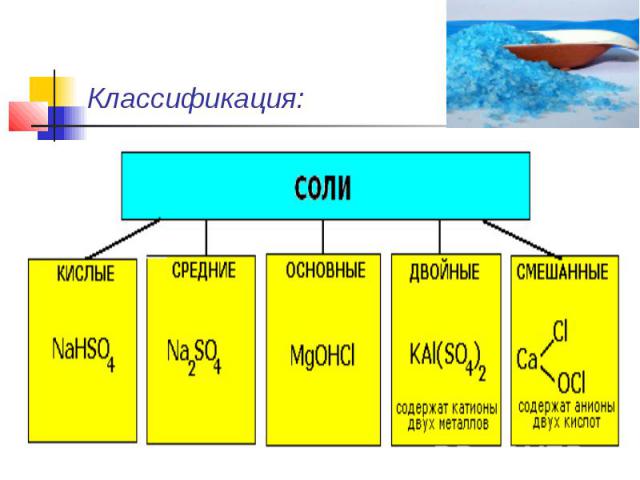
Классификация:

Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла. ( KCl )Кислые соли — атомы водорода в кислоте замещены атомами металла частично. ( NaHCO3)Основные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. ( ( CuOH)2CO3)

Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами.( KAl(SO4)2 х 12H2O )Смешанные соли — в их составе присутствует два различных аниона.(Ca(OCl)Cl)

Комплексные соли — в их состав входит комплексный катион или комплексный анион ( K3[Fe(CN)6] ).

Получение Реакция нейтрализации. H2SO4 + 2KOH = K2SO4 + 2H2OРеакция кислот с основными оксидами. H2SO4 + CuO = CuSO4 + H2OРеакция оснований с кислотными оксидами. Ca(OH)2 + CO2 = CaCO3 + H2O

Реакция основных и кислотных оксидов между собой. CaO + SO3 = CaSO4 Реакция кислот с солями. H2S + CuCl2 = CuS + 2HClРеакция оснований с солями. 3NaOH + FeCl3 = Fe(OH)3 +3NaCl
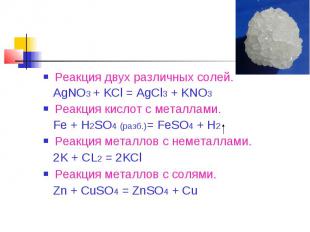
Реакция двух различных солей. AgNO3 + KCl = AgCl3 + KNO3Реакция кислот с металлами. Fe + H2SO4 (разб.)= FeSO4 + H2Реакция металлов с неметаллами. 2K + CL2 = 2KClРеакция металлов с солями. Zn + CuSO4 = ZnSO4 + Cu

Химические свойства 1. Взаимодействие с металлами. Каждый левее стоящий металл в ряду напряжений вытесняет последующий из раствора его соли.Fe + CuCI2=Cu + FeCI2Fe° + Cu²+ + 2CI = Cu° + Fe²+ +2CIFe° + Cu²+ = Cu° + Fe²+или Fe° – 2e → Fe²+ │ окисляется (восстановитель)Cu²+ + 2e → Cu° │ восстанавливается (окислитель)

2. Взаимодействие со щелочами. В результате обязательно должно образоваться нерастворимое основание. CuCL2 + 2NaOH = Cu(OH)2 + 2NaCl

3. Взаимодействие с кислотами. NaSiO3 + 2HNO3 = NaNO3 + HSiO34. Взаимодействие растворимых солей между собой с образованием осадка . NaCl + AgNO3 = NaNO3 + AgCl

Применение

О соли. (Мёртвое море)

Розовое озеро в Сенегале. Это озеро имеет такой цвет из-за большого количества микроорганизмов и полезных ископаемых.Местные женщины проводят до 14 часов в день собирая там соль.

Самое большое солевое озеро в мире расположено на юге пустынной равнины Альтиплано, в Боливии, на высоте около 3700 м. Его площадь составляет 10,5 квадратных километров. В центре толщина соли достигает 10 метров. Это озеро содержит более 10 миллиардов тонн соли. Когда Salar de Uyuni покрывается водой, в нем отражается каждое облако.

Добыча соли.







![Комплексные соли — в их состав входит комплексный катион или комплексный анион ( K3[Fe(CN)6] ). Комплексные соли — в их состав входит комплексный катион или комплексный анион ( K3[Fe(CN)6] ).](https://fs1.ppt4web.ru/images/3958/66527/640/img7.jpg)