Презентация на тему: Сходства и различия в теориях разбавленных растворов Аррениуса и Менделеева

Министерство образования РФМОУ СОШ № 12Городская научно-практическая конференция«Первые шаги в науку»«Сходства и различия в теориях разбавленных растворов Аррениуса и Менделеева»Выполнила: ученица 10 класса «а» МОУ СОШ №12 Пириева Софья Руководитель: преподаватель химии Харитонова Лариса ГригорьевнаМО Нижнеудинский район, 2008 г.

Вступление В наше время теория растворов получила широкое развитие, но всего лишь 100 лет назад о ней было мало что известно. Существует много примеров из истории науки, когда почти одновременно рождались две теории, описывающие какую-либо группу явлений, казалось бы, с прямо противоположных позиций. Однако затем выяснялось, что обе теории могут быть увязаны друг с другом. При этом одна правильно обрисовывала общую картину, тогда как вторая более глубоко вскрывала сущность сторон этих явлений. В 1887 С. Аррениус сформулировал основные положения теории электролитической диссоциации, а в 1889 году Д.И. Менделеев представил гидратную теорию растворов. И после этого долгие годы они вели ожесточенные споры о том, чья же теория верна. Так сложилось, что Сванте Аррениус, оказался более настойчивым в пропаганде своего учения в научной печати, поэтому большинство химиков приняли его сторону. Лишь сорок лет спустя, благодаря трудам великого русского химика И.А. Каблукова родилась современная синтетическая теория растворов, которая объединила эти противоположные взгляды в единое, стройное учение.

Отсюда вытекает цель работы:изучить основные идеи, определить основные различия и возможные точки соприкосновения теории электролитической диссоциации С. Аррениуса и гидратной теории растворов Д.И. Менделеева.Задачи:1.Изучение и анализ учебной, научно- популярной литературы, материалов в сети «Интернет» по данной теме. 2.Разработка и проведение химического эксперимента по данному вопросу.3.Подготовка презентации.

Основная часть Теоретическая частьОсновные положения теории С. Аррениуса и Д. И. Менделеева Электролитическая диссоциация происходит в результате движения в растворе заряженных частиц – ионов. Причина появления в растворах заряженных частиц была совершенно непонятной. Само название «электролит» (от греч.lysis – разрушение, растворение) предполагало, что ионы появляются в растворе при пропускании через него электрического тока. В 1887 году С.Аррениус, исследуя электропроводность водных растворов, высказал предположение, что в таких растворах вещества распадаются на заряженные частицы – ионы. Ученые – современники Аррениуса - вначале не поняли его теорию. У многих из них в то время еще не было четкого понимания, чем ионы отличаются от нейтральных атомов. В результате диссертация Аррениуса получила ряд отрицательных отзывов. К числу самых непримиримых противников Аррениуса принадлежал Д.И. Менделеев, создавший «химическую» теорию растворов, он считал, что в растворах происходят, химические взаимодействия между растворенным веществом и растворителем.

СИНТЕТИЧЕСКАЯ ТЕОРИЯ РАСТВОРОВ КАК ПРОЯВЛЕНИЕ ЗАКОНА ЕДИНСТВА И БОРЬБЫ ПРОТИВОПОЛОЖНОСТЕЙ При образовании раствора в общем случае происходит изменение свойств и растворителя, и растворенного вещества. Сторонники «физической» теории растворов трактовали образование раствора как суммарный результат молекулярного движения и взаимного сцепления частиц. Наоборот, приверженцы «химической» теории подчеркивали преобладающую роль взаимодействия между различными частицами в растворе, полагая, что силы, действующие в растворах, чисто химические. Эти крайние точки зрения дополняют друг друга, поэтому правильнее было бы не противопоставлять их, а объединять. Понятие о сольватации (частный случай – гидратация) было введено И. А. Каблуковым (1891). В результате различных взаимодействий в растворе могут возникнуть соединения переменного состава между частицами растворенного вещества и растворителя. Такие соединения называются сольватами (для водных растворов - гидратами).

Практическая частьХИМИЧЕСКИЕ ЭКСПЕРИМЕНТЫ, ПОДТВЕРЖДАЮЩИЕ ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ СВАНТЕ АРРЕНИУСА И Д. И. МЕНДЕЛЕЕВА Для подтверждения основных положений теории Менделеева проведена серия экспериментов:1.Растворение спирта в воде с уменьшением объема раствора.Для эксперимента взяли 5 мл этанола и 5 мл воды. После растворения спирта в воде объём раствора составил 9 мл. Это произошло в результате того, что при протекании данной реакции образовалась химическая связь, между катионом гидроксония и этилат – анионом, которые находятся близко друга от друга. Такую реакцию называют гипертермической: C2H5OH + H2O = C2H5O- ● H3O+


2. Растворение серной и хлороводородной кислот в воде, сопровождающееся выделением тепла.В ходе эксперимента мы растворяли концентрированную серную кислоту в воде и фиксировали изменение температуры. Исследование тепловых эффектов при разбавлении серной кислоты дало поразительные результаты. Оказалось, что чем сильнее разбавляется серная кислота, тем меньше теплоты выделяется. Дело в том, что вокруг каждого иона образуется многослойная сфера из огромного числа молекул воды – химики образно называют такой слой гидратной шубой иона.
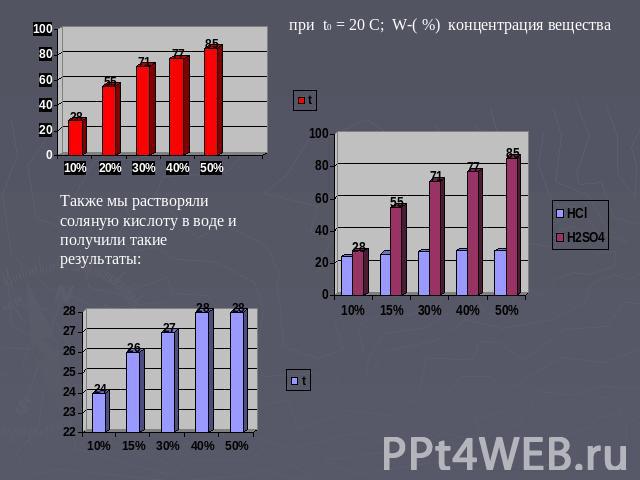
при t0 = 20 С; W-( %) концентрация вещества Также мы растворяли соляную кислоту в воде и получили такие результаты:

3. Растворение безводного медного купороса и воды с изменением цвета.Безводный сульфат меди(II) CuSO4 бесцветен. При растворении в воде происходит гидратация ионов; гидратированные ионы меди имеют голубую окраску .При взаимодействии раствора с растворителем образуется химическая связь с выделением энергии: 1) либо на разогрев жидкости 2) либо разрыв связей между катионами и анионами. CuSO4● 5H2O При помощи нескольких кристалликов медного купороса можно легко доказать присутствие воды в ректификате. Для этого нагреем в тигле несколько кристалликов сульфата меди до образования бесцветной безводной соли. Затем щепотку полученной соли добавим к пробе спирта и встряхнём. Наличие воды обнаруживается по голубому окрашиванию раствора.

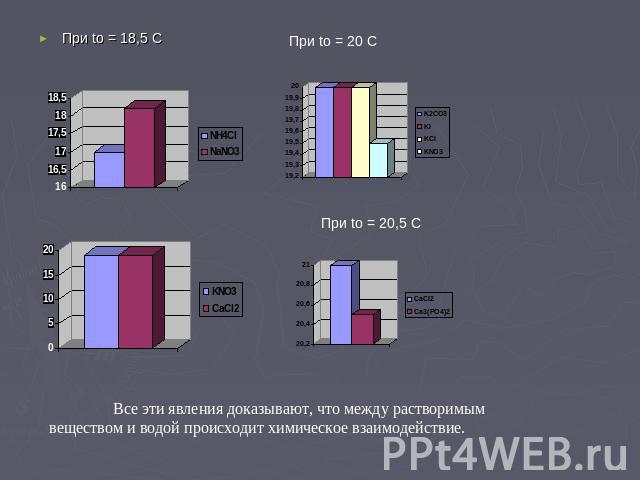
4. Растворение солей в воде с изменением температуры. То, что при образовании растворов молекулы растворителя и растворённого вещества не просто перемешиваются, можно продемонстрировать многими опытами. Если суммарная энергия гидратации катионов и анионов при образовании раствора больше энергии кристаллической решетки, растворение будет сопровождаться нагреванием, а если меньше – охлаждением раствора. Именно поэтому при растворении в воде таких веществ как LiCl, безводный CaCl2 и многих других раствор нагревается, а при растворении КCl, К NO3, NН4 NO3 и некоторых других – охлаждается. Охлаждение может быть таким сильным, что стакан, в котором готовят раствор, покрывается снаружи росой и может даже примерзнуть к мокрой подставке.
При tо = 18,5 С При tо = 20 С При tо = 20,5 С Все эти явления доказывают, что между растворимым веществом и водой происходит химическое взаимодействие.

Заключение: 1. В течение XIX в. и первой четверти XX в. происходила серьезная борьба двух теорий растворов Аррениуса и Менделеева.2. К началу XX века возможности теории Аррениуса исчерпаны, все сегодняшние открытия делаются на основе теории растворов Менделеева.3. Благодаря работам И. А. Каблукова к 1915 году соперничавшие теории объединились в единую теорию.

Список литературы http://www.himhelp.ruБЭКМ, 2004 г.Браун Т., Лемей Г. Ю. Химия в центре наук. М: Мир, 1986.К. Зоммер, К. Х. Вюнш, М. Цеттлер. Химия. Справочник школьника и студента.Э. Гроссе, Х. Вайсмантель. Химия для любознательных. Ленинград. Издательство химия. 1985.К. Зоммер, К. Х. Вюнш, М. Цеттлер. Химия. Справочник школьника и студента.Э. Гроссе, Х. Вайсмантель. Химия для любознательных. Ленинград. Издательство химия. 1985.