Презентация на тему: «Сероводород»

Неорганическая химия Сероводород

С Е Р О В О Д О Р ОД Подготовили: ученики 9 класса А Гимназии №1 Зорин Сергей Шакенов Серик Югай Дмитрий Огай Артём
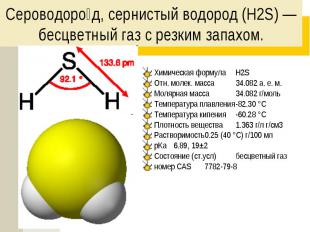
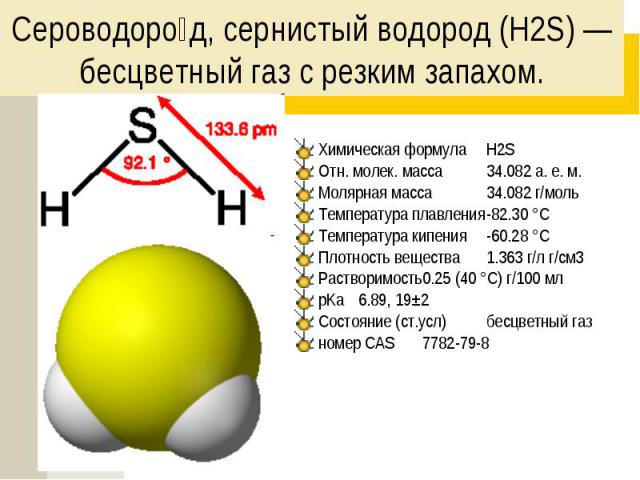
Сероводоро д, сернистый водород (H2S) — бесцветный газ с резким запахом. Химическая формула H2S Отн. молек. масса 34.082 а. е. м. Молярная масса 34.082 г/моль Температура плавления -82.30 °C Температура кипения -60.28 °C Плотность вещества 1.363 г/л г/см3 Растворимость 0.25 (40 °C) г/100 мл pKa 6.89, 19±2 Состояние (ст.усл) бесцветный газ номер CAS 7782-79-8

Нахождение в природе Встречается в природе в составе нефти, природного газа, вулканического газа и в горячих источниках.

Свойства

Получение В лаборатории обычно получают действием разбавленных кислот на сульфиды: FeS + 2HCl = FeCl2 + H2S Или при добавлении к сульфиду алюминия воды: Al2S3 + H2O = 2Al(OH)3 + H2S (реакция отличается чистотой полученного сероводорода)

Применение Сероводород из-за своей токсичности находит ограниченное применение. В аналитической химии сероводород и сероводородная вода используются как реагент для осаждения тяжёлых металлов, сульфиды которых очень слабо растворимы В медицине — в составе сероводородных ванн Сероводород применяют для получения серной кислоты, элементной серы, сульфидов Используют в органическом синтезе для получения тиофена и меркаптанов В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического и химического сырья.

Токсикология Очень токсичен. При высокой концентрации однократное вдыхание может вызвать мгновенную смерть. При небольших концентрациях довольно быстро возникает адаптация к неприятному запаху «тухлых яиц», и он перестаёт ощущаться. Во рту возникает сладковатый металлический привкус [2] При большой концентрации не имеет запаха.