Презентация на тему: Основания

Основания Работу выполнили учащиеся 8А класса: Арзамазова Евгения, Максименко Полина, Рахвалова Ангелина Руководитель: учитель химии Барахтенко Ольга Ивановна

Основания - сложные вещества, состоящие из атомов металла, соединённых с одной или несколькими гидроксогруппамиОбщая формула: Me(OH)n

Классификация основания Растворимые (щелочи)Li OH, Ba(OH)2(гидроксиды Ме главных подгрупп I и II групп) НерастворимыеCu(OH), Fe(OH)2 (гидроксиды всех остальных Ме)
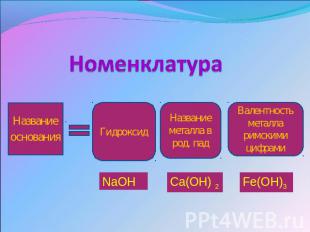
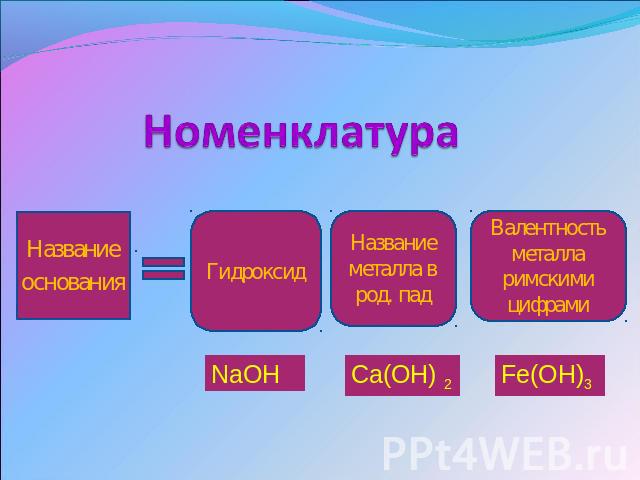
Номенклатура Названиеоснования Гидроксид Название металла в род. пад Валентностьметалла римскими цифрами NaOH Ca(OH) 2 Fe(OH)3

Химические свойства оснований Качественные реакцииВзаимодействия с кислотамиВзаимодействие с оксидами неметаллов

Качественные реакции Индикатор – вещество, изменяющее свой цвет в зависимости от среды растворов Действие щелочей на индикаторы

Взаимодействие с кислотами

Нейтрализация Нейтрализация- реакция кислот с основаниями, приводящая к образованию соли и воды:NaOH + HCl = NaCl + H2O Fe(OH)3 + 3HCl = FeCl3 + 3H2OЗа прохождением реакций можно наблюдать по изменениям окраски индикаторов.Вывод: В результате данных реакций раствор стал нейтральными.

Взаимодействие с оксидами неметаллов NaOH + CO2 = Na2CO3 + H2OCa(OH)2 + CO2 = CaCO3 + H2O(качественная реакция на гидроксид кальция – помутнение известковой воды)

КИСЛОТЫ

Кислоты – сложные вещества, состоящие из атомов водорода, способных замещаться на металл и кислотного остатка ОБЩАЯ ФОРМУЛА HR

НОМЕНКЛАТУРА КИСЛОТ

Классификация А) по числу атомов водорода (основность) Кислоты oдноосновные НCl HNO3 двухосновные H2S H2SO4 трехосновные H3PO4Б) по наличию кислорода в кислотном остатке H2SO4 – серная кислота HNO3 - азотная кислотаH3PO4 – фосфорная кислота

Химические свойства кислот Действие кислот на индикаторыВзаимодействие с металламиС основными оксидамиС основаниямиС солями

Качественные реакции Действие кислот на индикаторы

2. Взаимодействие с металлами2HCl + Fe=FeCl2 + H2H2SO4 + Zn=ZnSO4 + H2(стоящими в электрохимическом ряду напряжения до водорода)

3. Взаимодействие с основными оксидамиt2HCl + CaO = CaCl2 + H2O tH2SO4+ CuO = CuSO4

4. Взаимодействие с основаниямиHCL + NaOH = NaCl + H2OH2SO4 + Ba(OH)2 = BaSO4 + 2H2O

5. Взаимодействие с солямиБолее сильные кислоты вытесняют из солей более слабые кислоты.2HCl + Na2S = H2S + 2NaCl 2HCl + Na2CO3 = 2NaCl + H2CO3

Нахождение кислот в природе(органические) яблочная муравьиная молочная лимонная щавелевая

Применение кислот Очистка поверхности металловОчистка нефтепродуктовПолучение красокПолучение лекарствПолучение пластмасс и искусственных волоконПолучение минеральных удобренийЭлектролит в аккумуляторахВ пищевой промышленности (органические)

Используемая литература: Г. Е. Рудзитис, Ф. Г. Фельдман Химия 8, 9 класс – М. Просвещение , 2008В. Г. Иванов Химия в формулах (справочные материалы) – М. Дрофа, 2008А. Е. Насонова Химия в таблицах (справочное пособие) – М. Дрофа, 2008Л. Ю. Аликберова Занимательная химия – М. Аст-Пресс, 1999Ю. Н. Кукушкин Химия вокруг нас – М. Высшая школа, 1992Малая детская энциклопедия Химия / сост. К. Люцис – М. Русское энциклопедическое товарищество, 2001Н. С. Ахметов Неорганическая химия (учебное пособие для учащихся 8-9 классов): В 2 ч. – М. Просвещение, 1992