Презентация на тему: Ковалентная полярная и неполярная связь

Ковалентная полярная и неполярная связь.
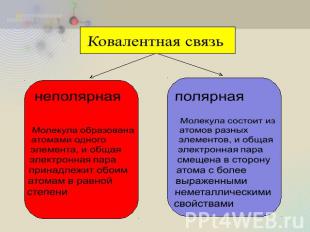
Ковалентная связь неполярная Молекула образована атомами одного элемента, и общая электронная пара принадлежит обоим атомам в равной степени полярная Молекула состоит из атомов разных элементов, и общая электронная пара смещена в сторону атома с более выраженными неметаллическими свойствами

Полярность связи характеризуется электроотрицательностью элемента. Электроотрицательность Элемента (ЭО) - это способность его атомов притягивать к себе общие электронные пары в соединении.

ЭО – это безразмерная, условная характеристика атома элемента. В периодах ЭО элементов возрастает с увеличением заряда ядер атомов (слева направо), а в главных подгруппах – снизу вверх. Чем больше ЭО элемента, тем сильнее его атомы притягивают электроны и труднее их отдают.

Общие электронные пары смещаются в сторону более электроотрицательного элемента, и чем больше разность величин ЭО (∆ЭО) связанных атомов, тем больше полярность связи. В формулах соединений менее электроотрицательный элемент пишут на первом месте.

Ковалентная неполярная связь – это связь между атомами с одинаковой электроотрицательностью; при её образовании общие электронные пары в равной степени принадлежат обоим атомам.

Ковалентная полярная связь – это связь между атомами, которые незначительно различаются по электроотрицательности; общие электронные пары смещены в сторону атома более электроотрицательного элемента.

Алгоритм составления схемы образования ковалентной связи. 1. Составить схемы электронного строения атомов.

2. Валентные электроны каждого атома обозначить точками вокруг символа элемента. У атома серы 2 неспаренных электрона (8-6=2) и до завершения внешнего слоя ему не хватает двух электронов, поэтому при образовании молекулы H2S образуются две пары общих электронов.

3. Составить электронную и структурную формулы образовавшейся молекулы.

4. Указать, что связь между атомами водорода и серы ковалентная полярная и общие электронные пары смещены в сторону атома серы, так как он более электроотрицателен.

Характеристики ковалентной связи Длина связи – это расстояние между ядрами атомов в молекуле. Длина связи в молекуле хлора Cl2 (связь одинарная) равна 0,198 нм, а в молекуле азота N2 (связь тройная) равна 0,109 нм. Значит, чем больше общих электронных пар у атомов в молекуле, тем меньше расстояние между ядрами атомов и прочнее химическая связь.

Энергия связи – это количество энергии, которое необходимо для разрыва связи. Её выражают в кДж/моль.

В молекуле азота ( )атомы связаны друг с другом прочнее, чем в молекуле хлора ( ), так как для разделения молекулы азота на отдельные атомы нужно затратить больше энергии. Итак, с увеличением числа связей между атомами в молекуле энергия связи увеличивается, а её длина уменьшается.

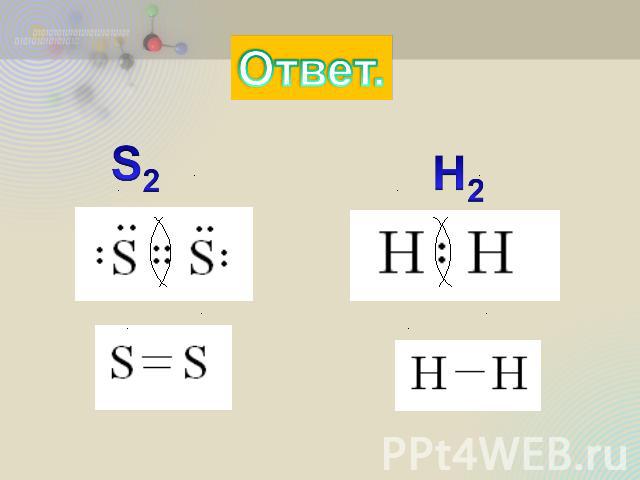
Практическая часть. Из приведённых формул Выпишите молекулы с ковалентной неполярной связью: H2O, S2, H2, H2S. Напишите их электронные и структурные формулы.
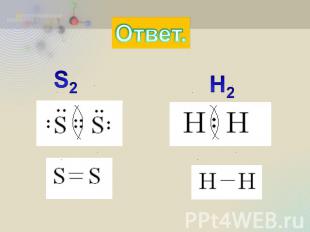
Ответ.

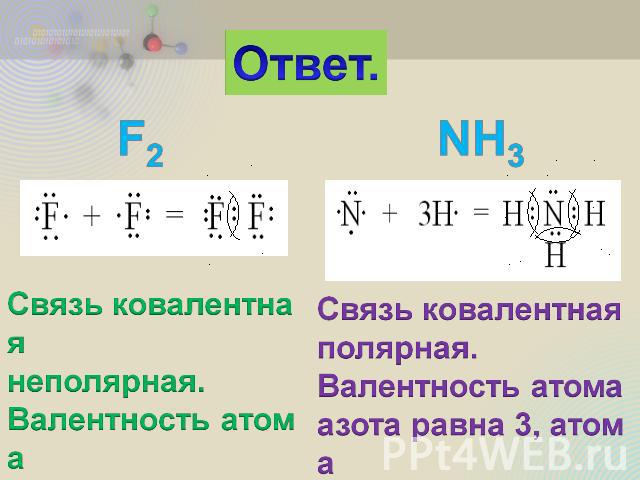
2. Составьте схемы образования химических связей для молекул F2 и NH3. Укажите тип химической связи и валентность каждого элемента.
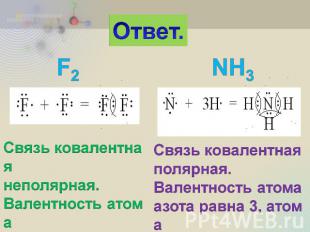
Ответ. Связь ковалентная неполярная. Валентность атома фтора равна 1. Связь ковалентная полярная. Валентность атома азота равна 3, атома водорода равна 1.