Презентация на тему: Элемент алюминий
Al Алюминий

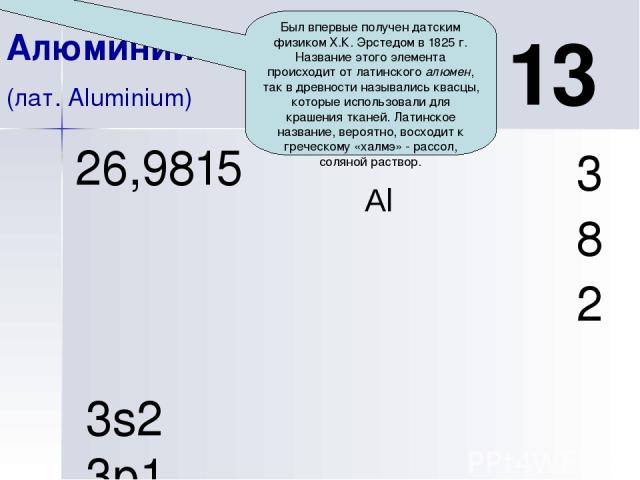
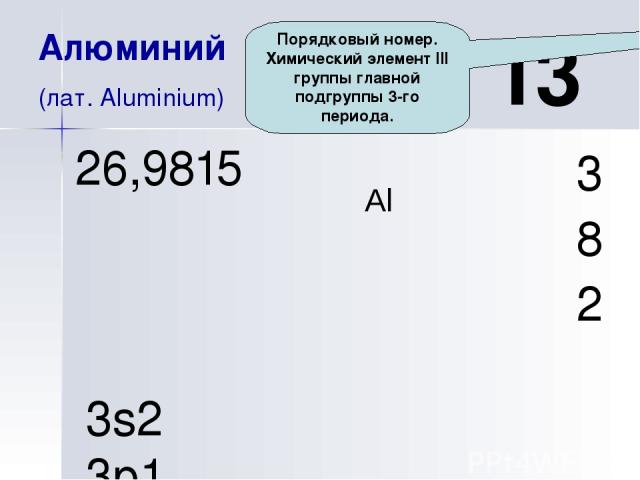
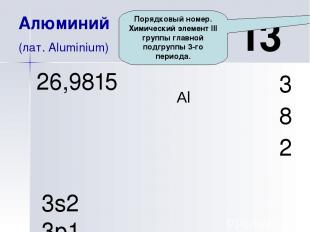
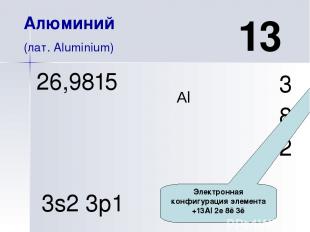
Al 13 Алюминий (лат. Aluminium) 3 8 2 26,9815 3s2 3p1 Порядковый номер. Химический элемент III группы главной подгруппы 3-го периода.

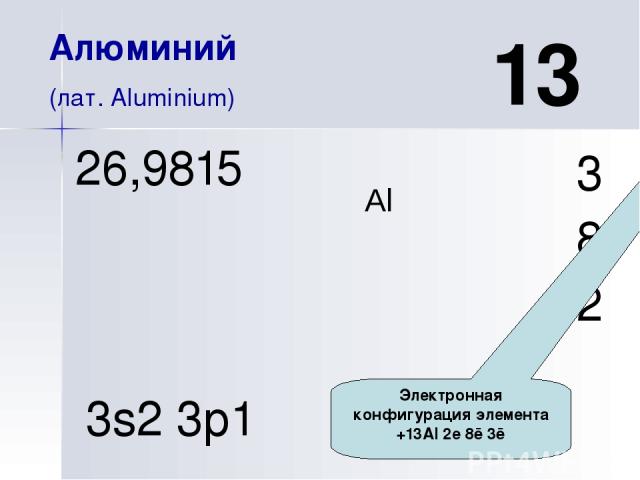
Al 13 Алюминий (лат. Aluminium) 3 8 2 26,9815 3s2 3p1 Электронная конфигурация элемента +13Al 2е 8ē 3ē
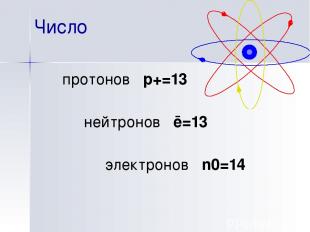
Число протонов p+=13 нейтронов ē=13 электронов n0=14

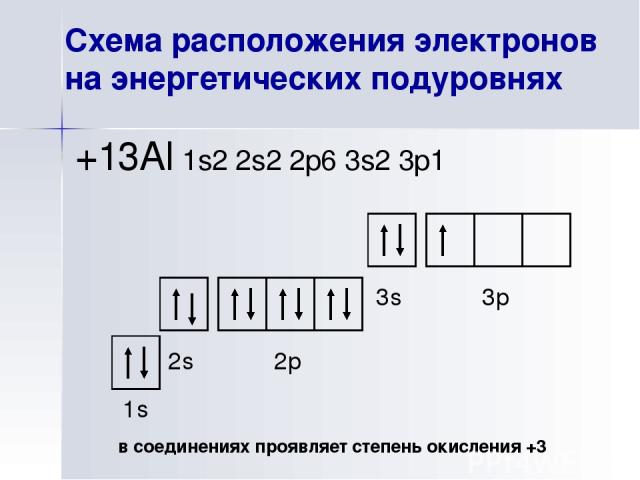
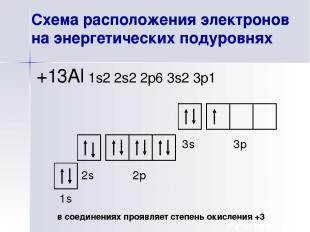
Схема расположения электронов на энергетических подуровнях +13Al 1s2 2s2 2p6 3s2 3p1 1s 2s 2p 3s 3p в соединениях проявляет степень окисления +3 При высокой температуре очень редко образует соединения со степенью окисления +1, +2.
Al – типичный металл Схема образования вещества Al 0- 3ē Al+3 Тип химической связи -металлическая Тип кристаллической решетки – кубическая гранецентрированная
Физические свойства вещества Al – серебристо-белый металл, пластичный, легкий, хорошо проводит тепло и электрический ток, обладает хорошей ковкостью, легко поддаётся обработке, образует лёгкие и прочные сплавы. =2,7 г/см3 tпл.=6600С Легко вытягивается в проволоку и прокатывается в фольгу толщиной до 0,01 мм.
Химические свойства вещества Al активный металл восстанавливает все элементы, находящиеся справа от него в электрохимическом ряду напряжения металлов, простые вещества – неметаллы. Из сложных соединений алюминий восстанавливает ионы водорода и ионы менее активных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, поскольку его поверхность покрыта защитной оксидной плёнкой Al2 O3 В ряду напряжений алюминий находится сразу же после щелочных и щелочноземельных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, поскольку его поверхность покрыта очень прочной тонкой пленкой оксида, которая защищает металл от воздействия компонентов воздуха и воды.

Алюминий реагирует: 1. 2Al+3O2 = 2Al2O3 + O – покрывается пленкой оксида, но в мелкораздроблен-ном виде горит с выделением большого количества теплоты. 2. 2Al + 3Cl2 = 2 AlCl3 (Br2, I3) – на холоду 3. 2Al + 3S = Al2S3 - при нагревании 4. 4Al + 3С = Al4С3 - при нагревании 5. Алюминотермия – получение металлов: Fe, Cr, Mn, Ti, W и другие, например: 3Al + 3Fe3O4 = 4Al2O3 + 9Fe Алюминий при нагревании сгорает на воздухе. Вследствие образования защитной пленки не реагирует с HNO3, не растворяется в H3PO4. С трудом взаимодействует с H2SO4, медленно – с растворами HNO3 и H3PO4, быстрее – с раствором HCl, растворяется в растворах щелочей: Al + 4HNO3 = Al(NO3)3 + NO + 2H2O/ При обычной температуре реагирует с Cl2, Br2, при нагревании – с F2, I2, S, C, N2; с H2 непосредственно не реагирует.

Получение вещества Алюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6), электролизом расплава AlCl3 (расходуется около 16 кВт·час на 1 кг Al) Электролиз: Al2O3 при 9500С в расплаве криолита: На катоде: Al3+ + 3e = Al0 На угольном аноде (расходуется в процессе электролиза): O2- - 2e = 00; C + O = CO; 2CO + O2 = 2CO2; Алюминий получают разложением электрическим током раствора его оксида в расплавленном криолите (Na3AIF6): (эл.ток) 2Al2O3 = 4 Al + 3O2 – 3352 кДж Из – за высокой энергии химической связи в оксиде процесс его разложения чрезвычайно энергоемок, что ограничивает использование алюминия.

Применение Al Основные свойства применения алюминия и его сплавов: Судостроение; Строительство; Самолетостроение; В химической технике; Автомобильная промышленность; Производство посуды; Производство алюминированных тканей; Изготовление аппаратуры для пищевой промышленности; Провода для линий электропередач; Получение металлов из их оксидов «алюминотермией»; Ракетостроение; Химическое машиностроение; Упаковочный материал; Производство пеноалюминия ρ = 0,19 г/см3

Ряд факторов применения алюминия: Алюминий – самый распространенный металл земной коры. Его ресурсы практически неисчерпаемы. Обладает высокой коррозионной стойкостью и практически не нуждается в специальной защите. Высокая химическая активность алюминия используется в алюминотермии. Малая плотность в сочетании с высокой прочностью и пластичностью его сплавов делает алюминий незаменимым конструкционным материалом в самолетостроений и способствует расширению его применения в наземном и водном транспорте, а также в строительстве. Относительно высокая электропроводность позволяет заменять им значительно более дорогую медь в электротехнике.

Оксид алюминия Al2О3: Очень твердый (корунд, рубин) порошок белого цвета, тугоплавкий - 20500С. Не растворяется в воде. Амфотерный оксид, взаимодействует: а) с кислотами Al2O3 + 6H+ = 2Al3+ + 3H2O б) со щелочами Al2O3 + 2OH- = 2AlO-2 + H2O Образуется: а) при окислении или горении алюминия на воздухе 4Al + 3O2 = 2Al2O3 б) в реакции алюминотермии 2Al + Fe2O3 = Al2O3 + 2Fe в) при термическом разложении гидроксида алюминия 2Al (OH)3 = Al2O3 + 3H2O

Белый нерастворимый в воде порошок. Проявляет амфотерные свойства, взаимодействует: а) с кислотами Al (OH)3 + 3HCl = AlCl3 + 3H2O б) со щелочами Al (OH)3 + Na OH = NaAlO2 + 2H2O Разлагается при нагревании 2Al (OH)3 = Al2O3 + 3H2O Образуется: а) при взаимодействии растворов солей алюминия с растворами щелочей (без избытка) Al3+ + 3OH- = Al (OH)3 б) при взаимодействии алюминатов с кислотами (без избытка) AlO-2 + H+ + H2O = Al (OH)3 Гидроксид алюминия Al(ОН)3:

Влияние соединений алюминия на загрязнение окружающей среды. Почти все загрязняющие вещества, которые первоначально попали в атмосферу, в конечном итоге оказываются на поверхности суши и воды. Оседающие аэрозоли могут содержать ядовитые тяжелые металлы – свинец, кадмий, ртуть, медь, ванадий, кобальт, никель. Обычно они малоподвижны и накапливаются в почве. Но в почву попадают с дождями также кислоты. Соединяясь с ними, металлы могут переходить в растворимые соединения, доступные растениям. В растворимые формы переходят также вещества, постоянно присутствующие в почвах, что иногда приводит к гибели растений. Примером может служить весьма распространенный в почвах алюминий, растворимые соединения которого поглощаются корнями деревьев. Алюминиевая болезнь, при которой нарушается структура тканей растений, оказывается для деревьев смертельной. В природе алюминий встречается только в виде соединений и по распространенности в земной коре занимает первое место среди металлов и третье – среди всех элементов (после кислорода и кремния). Общее содержание алюминия в земной коре составляет 8,8 % по массе.

Металл будущего Вывод: Обладая такими свойствами как лёгкость, прочность, коррозионноустойчивость, устойчивость к действию сильных химических реагентов - алюминий нашёл большое значение в авиационном и космическом транспорте, применение во многих отраслях народного хозяйства. Особое место занял алюминий и его сплавы в электротехнике, а за ними будущее нашей науки и техники.